(6分,每空1分)X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子L层电子数是K层电子数的2倍 |
| Y |
Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z |
Z存在质量数为23,中子数为12的核素 |
| W |
W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W位于元素周期表第___周期第___族,其基态原子最外层有___个电子。
(2)X元素基态原子的价电子的电子排布图为______________________;X的电负性比Y的____(填“大”或“小”);X和Y的气态氢化物中,较稳定的是______(写化学式)
Ⅰ在①CH2=CH2②C6H6③CH3CH2OH④CH3COOH⑤聚乙烯五种物质中:
(1)能使Br2的CCl4溶液褪色的是________;
(2)属于高分子化合物的是________;
(3)能与Na2CO3溶液反应的是________;
(4)能发生酯化反应的是________;
(5)既能发生取代反应又能发生加成反应的是________。
Ⅱ A、B是相对分子质量不相等的两种烃,无论二者以何种比例混合,只要混合物的总质量一定,完全燃烧后所产生的CO2的质量就不变,试写出两组符合上述情况的烃的结构简式:
(1)第一组和。
(2)第一组和。
(3)A、B应满足的条件是_______________________________________。
氯化铵简称“氯铵”,又称卤砂,为无色晶体或白色结晶性粉末,易溶于水中,在工农业生产中用途广泛。以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下: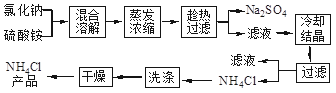
氯化铵和硫酸钠的溶解度随温度变化如图所示。回答下列问题: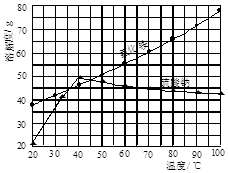
(1)实验室进行蒸发浓缩用到的主要仪器有 、烧杯、玻璃棒、酒精灯等。
(2)实验过程中趁热过滤的目的是 。
(3)写出“蒸发浓缩”时发生的化学方程式: 。
(4)某研究性学习小组为测定该NH4Cl产品中氮的含量,设计了如图装置,并进行了讨论。
甲同学:根据此实验测得的数据,计算的NH4Cl产品的含氮量可能偏高,因为实验装置中存在一个明显缺陷是: ____ 。
乙同学:实验过程中,往烧瓶中加入的浓氢氧化钠溶液的离子反应方程式为 ,反应过程中NaOH一定要足量并充分加热,原因是 。
用改进后的实验装置重新进行实验,称取13.0gNH4Cl产品,测得实验后B装置增重3.4g。则该化肥含氮量为 。
下图表示常见元素单质及化合物相应转化关系,部分反应的产物没有全部列出。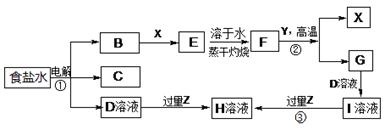
已知:B是一种黄绿色气体,C在所有气体中密度最小,D是一种碱;X、Y是生活中应用最为广泛的金属,F是一种红棕色氧化物,常用作红色油漆和涂料;Z为气态氧化物。
请回答下列问题:
(1)气体B具有(填“还原性”、“氧化性”或“漂白性”),反应②属于四种基本反应类型反应中的。
(2) 有学生认为B与X反应的产物E不一定是纯净物。他认为产物中可能还有(填化学式),为验证其猜想该同学设计了相关实验,你认为他需要选择的试剂为(填序号)。
a.酸性高锰酸钾溶液 b.NaOH溶液 c.KSCN溶液 d.稀硫酸
(3)若Z能导致温室效应,则反应③的离子反应方程式为。
(4)若Z是我国酸雨形成的罪魁祸首,目前应用最广泛的工业处理含Z废气的方法是在一定条件下与生石灰作用而使其固定,产物可作建筑材料,反应的化学方程式为。
(5)若Z是形成酸雨的另一种主要物质,Z与足量的D溶液反应时能被完全吸收,且生成两种盐(物质的量之比为1:1),请写出该反应的化学反应方程式。
现有下列物质:①铜②蔗糖③CuO④NaHSO4 ⑤Ba(OH)2⑥氧气⑦盐酸⑧干冰⑨胆矾⑩水
(1)上述物质分类中不属于电解质的有(填序号),④在水溶液中的电离方程式为。
(2)碳酸钠俗名纯碱或苏打,在外观上与食盐相似。在一定条件下,上述物质中能用来区分碳酸钠与食盐的物质有(填序号)。
(3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为:H++OH-=H2O,则该反应的化学方程式为。
(4)向④ 溶液中缓缓滴加⑤ 溶液至混合溶液刚好呈中性时的离子方程式为:_______。
(5)上述物质中有四种物质在一定条件下相互作用可生成一种新物质—碱式碳酸铜[Cu2(OH)2 CO3],请写出该反应的化学反应方程式________________。
在半导体工业中有这样一句话:“从沙滩到用户”,其中由粗硅制纯硅的常用方法为:Si(粗)+2Cl2=SiCl4 SiCl4+2H2=Si(纯)+4HCl。若在25℃101KPa条件下反应生成HCl气体49L(注:25℃101KPa条件下气体摩尔体积为24.5L/mol)则:
(1)反应生成HCl气体的质量为__________,转移电子的个数为_____________。
(2)反应生成的HCl气体溶于127mL水中,得到密度为1.20g/mL的盐酸,此盐酸的物质的量浓度为。
(3)“从沙滩到用户”涉及到多个反应,其中制取粗硅的反应方程式为,纯净的石英砂与烧碱反应可以制得水玻璃,反应的离子方程式为。
(4)普通玻璃若以氧化物形式表示其组成为(质量分数):Na2O 13%,CaO 11.7%,SiO2 75.3%。现以石灰石、纯碱和石英为原料生产这种玻璃10t,石灰石的利用率为80%,纯碱和石英的利用率为95%,至少需要上述原料的质量是t(保留两位小数)。