在理论上不能用于设计原电池的化学反应是
| A.H2SO4(aq)+BaCl2(aq)=2HCl(aq)+BaSO4(s) △H<0 |
B.CH3CH2OH(l)+3O2(g)  2CO2(g)+3H2O(l) △H<0 2CO2(g)+3H2O(l) △H<0 |
| C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) △H<0 |
| D.3Cu(s)+8HNO3(aq)=3Cu(NO3)2(aq)+2NO(g)+4H2O(l) △H<0 |
有两个极易导热的密闭容器a和b(如图所示),a容器体积恒定,b容器压强恒定。在同温同压和等体积条件下,向a和b两容器中通入等物质的量的NO2,发生反应: 2NO2 N2O4△H<0,则以下说法正确的是
N2O4△H<0,则以下说法正确的是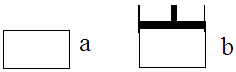
| A.反应起始时两容器的反应速率va和vb的关系:va<vb |
| B.反应过程中两容器内的反应速率va和vb的关系:va<vb |
| C.反应达到平衡时,两容器内压强相同 |
| D.反应达到平衡时,两容器的NO2的转化率相同 |
可逆反应A(g)+B C(g)+D,达到平衡时,下列说法不正确的是
C(g)+D,达到平衡时,下列说法不正确的是
| A.若B是气体,增大A的浓度会使B转化率增大 |
| B.若增大A的浓度,平衡体系颜色加深,D不一定是有颜色的气体 |
| C.升高温度,C百分含量减少,说明正反应是放热反应 |
| D.增大压强,平衡不移动,说明B是气体 |
某反应:2A(g) 3B(g)的各物质的浓度隨时间变化如图所示,则有关反应速率表示正确的是
3B(g)的各物质的浓度隨时间变化如图所示,则有关反应速率表示正确的是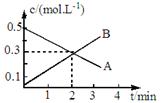
A、v(A)=0.1mol/(L.min) B、v(B)=0.2mol/(L.min)
C、v(A)=" v(B)" ="0.5" mol/(L.min) D、v(A)=" v(B)" ="0.3" mol/(L.min)
已知化学反应A2(g) + B2(g) = 2AB(g)的能量变化如图所示,判断下列叙述中正确的是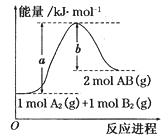
| A.每生成2分子AB吸收bkJ热量 |
| B.该反应热△H= +(a-b)kJ/mol |
| C.加入催化剂,该化学反应的反应热变大 |
| D.断裂1molA—A和1molB—B键,放出akJ能量 |
对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述中正确的是
4NO(g)+6H2O(g),下列叙述中正确的是
| A.达到化学平衡时4v正(O2)=5v逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大 |
| D.化学反应速率的关系是2v逆(NH3)=3v正(H2O) |