氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s)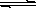 Cu2+(aq)+ 2OH-(aq),常温下其Ksp=2×10-20则:
Cu2+(aq)+ 2OH-(aq),常温下其Ksp=2×10-20则:
(1)某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH大于 。
(2)除去CuCl2溶液中少量的Fe2+,可以按照下面的流程进行: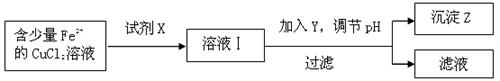
已知Fe2+、Cu2+和Fe3+三种离子开始沉淀和完全沉淀时溶液pH值如下:
| 金属 离子 |
pH |
|
| 开始沉淀 |
完全沉淀 |
|
| Fe2+ |
7.6 |
9.6 |
| Cu2+ |
4.4 |
6.4 |
| Fe3+ |
2.7 |
3.7 |
①下列物质中适合作为试剂X的是( )
A.H2O2 B.KMnO4 C.HNO3 D.Cl2
②加入的Y及调节的pH范围是( )
A.CuCO3 3.7~4.3 B.CuO 3.7~6.4
C.NaOH 3.7~4.2 D.NH3·H2O 3.7~4.0
检验Z沉淀完全的方法是:取1~2mL滤液于小试管中,加入1~2滴 溶液,现象 ,则沉淀完全。
(17分)I.工业上有一种用CO2来生产甲醇燃料的方法:
将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。图中数据a(1,6)表示:在1 min时H2的物质的量是6 mol。
(1)a点正反应速率(填“大于”“等于”或“小于”)逆反应速率。其化学平衡常数K=
(2)下列时间段平均反应速率最大的是,
| A.O~1 min | B.1~3 min | C.3~8 min | D.8~11 min |
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线I对应的实验条件改变是,曲线Ⅱ对应的实验条件改变是,体积不变再充入3molCO2和4 mol H2,H2O(g)的体积分数(填“增大”“不变”或“减小”)
Ⅱ.某实验小组欲探究反应速率与温度的关系,现有1mol/L的KI溶液、0.1mol/L的H2S04溶液、淀粉溶液,则实验时这几种试剂的加入顺序为:KI溶液、、;
反应的方程式为
Ⅲ. 粗镍样品中含Fe、Zn、Ag、Cu等四种金属杂质,为获得高纯度的镍,某兴趣小组同学拟用铅蓄电池为电源,粗镍及石墨为电极,电解硝酸镍溶液对粗镍进行提纯。
(1)电解结束后,在阳极附近的沉淀物中,主要的金属单质为(填化学式)。
(2) 若按上图所示连接对铅蓄电池进行充电。充电一段时间后。则在A电极上生成(填化学式)。B电极上的电极反应式为;充电完毕。铅蓄电池的正极是极(填“A”或“B”)。
(3)如用甲烷燃料电池为电源,在25℃、101 kPa时,若CH4在氧气中直接燃烧生成1 mol水蒸气放热401 kJ,而l g水蒸气转化成液态水放热2.445 kJ,则CH4的燃烧热为(取整数)kJ·mol-。
A、B、C、D、E、F六种化合物。其中A、B、C、D、E均由短周期元素组成,焰色反应均呈黄色,B、C、E均由三种元素组成,B、C的组成元素相同,且C的摩尔质量比B大80g/mol请回答下列问题:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为(填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(2)下表为B与F实验的部分内容:
| 序号 |
主要实验步骤及实验现象 |
| ① |
在含有B的溶液中,加入稀H2S04,产生浅黄色浑浊和无色有刺激性气味的气体。 |
| ② |
20 ml沸水中滴加F的饱和溶液1~2ml,所得液体呈红褐色 |
| ③ |
将实验②得到的红褐色液体加热蒸发、灼烧,最终得到红棕色固体 |
写出B与稀H2S04反应的离子方程式:;
写出②中反应的化学方程式:。
(3)现由6种粒子Mn2+、MnO4一、H十、H2 0、X2Y82一(C中含有的阴离子)、XY42一完成一个离子方程式,已知Mn2+为还原剂,得到1mol MnO4一需氧化剂的物质的量为。
(4)化合物D和E可以相互转化: 若有D和E·XH20的混合物13.04g,加热到完全反应后,气体产物通过浓H2S04增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为,E·XH20的化学式为。
若有D和E·XH20的混合物13.04g,加热到完全反应后,气体产物通过浓H2S04增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为,E·XH20的化学式为。
(14分)某学生实验小组拟用孔雀石(主要成分是Cu(OH)2·CuC03,其杂质主要为FeC03等)制胆矾,实验设计流程如下:
回答下列问题:
(1)步骤(a)中,实验研磨孔雀石的仪器名称;用硫酸浸取的化学方程式:
(2)步骤(b)中,pH控制在3.O~3.5,其目的是;加过氧化氢发生反应的离子方程式为。
(3)怎样判断蒸发浓缩已完成:。
(4)将制得的样品用热重仪进行热重分析,热重仪原理及热重记录如下表:
写出212~248℃温度范围内发生反应的化学方程式。
(5) FeC03为白色沉淀,此沉淀的Ksp(FeC03)=2×10-11,将FeCl2的稀溶液与Na2CO3溶液等体积混合,若FeCl2的浓度为2×lO一5mol·L-1.则生成沉淀所需Na2CO3溶液的最小浓度为mol·L-1。
为了检验淀粉水解的产物,某学生设计了如下实验方案:
请回答下列问题:
(1)试剂1为20%的H2SO4溶液,其作用是:作用。
(2)试剂2为 溶液,其作用是;
发生反应的离子方程式为:。
(3)为检验淀粉液是否已完全水解,取少量水解液于试管中,加入碘水,则证明淀粉未完全水解的现象是。
苯是最重要的基本有机化工原料之一,现利用苯,同时使用其他部分试剂,可实现如下转化: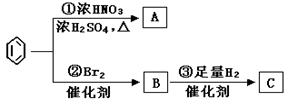
请回答下列问题:
(1)写出下列反应的化学方程式:
反应①:;反应②:;
(2)上述反应①~③中,属于加成反应的是 (填序号)。
(3)C的结构简式为:。