能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是
| A.某温度下,测得溶液的pH < 7 |
| B.溶液中c(Na+)=c(A2-) |
| C.溶液中存在Na+、HA-、A2-、 H2A 多种微粒 |
| D.NaHA溶液可与等体积等物质的量浓度的NaOH溶液恰好反应 |
下列表述不正确的是( )
| A.131I与127I互为同位素,化学性质几乎相同 |
| B.pm 2. 5含有铅、镉、铬、钒等对人体有害的金属元素 |
| C.除去SO2中混有的少量HCl,使气体通过盛有饱和NaHSO3溶液的洗气瓶 |
| D.为了证明氢氧化钠是离子化合物,可在瓷坩埚中将氢氧化钠固体熔化后测其导电性 |
铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼
金属铝。下列说法不正确的是()
| A.①、②中除加试剂外,还需要进行过滤操作 |
| B.a、b中铝元素的化合价相同 |
| C.③中需要通入过量的氨气 |
| D.④进行的操作是加热,而且d一定是氧化铝 |
现有一包铝热剂是铝粉和氧化铁(Fe2O3)粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(假定反应前后溶液的体积不变):
①向其中一份固体中加入100 mL 2.0mol•L-1的NaOH溶液,加热使其充分反应后过滤,测得溶液中的c(OH-)=1mol•L-1
②向另一份固体中加入100 mL 4.0 mol•L-1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且c(H+)=0.1mol•L-1则产生的气体的体积(标准状况)为()
| A.2.856L | B.2.448L | C.2.688L | D.2.352L |
下列实验不能获得成功的是()
| 实验目的 |
实验步骤 |
|
| A. |
探究催化剂对化学反应速率的影响 |
向H2O2溶液中滴加少量FeCl3溶液 |
| B. |
探究乙醇能发生氧化反应 |
将铜丝在酒精灯加热后,立即伸入无水乙醇中 |
| C. |
探究石蜡油分解的产物不都是烷烃 |
将石蜡油加强热产生的气体通入溴的四氯化碳溶液中 |
| D. |
探究蔗糖水解的产物中是否含有葡萄糖 |
取少量蔗糖溶液加稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并且加热 |
下列关于苯的叙述正确的是
A.反应①常温下能进行,其有机产物为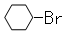 |
| B.反应②不发生,但是仍有分层现象,紫色层在下层 |
| C.反应③为加成反应,产物是三硝基甲苯 |
| D.反应 ④中1mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键 |