(12分)
向一个固定体积的密闭容器充入2 mol A和1 mol B,发生如下反应:
2A(g) + B(g)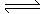 3C(g) + D(g),2分钟后,反应达到平衡,C的浓度为1.2 mol/L。
3C(g) + D(g),2分钟后,反应达到平衡,C的浓度为1.2 mol/L。
(1)平衡后继续向容器中充入惰性气体,平衡_________移动。(填“正向”,“逆向”,“不”)
(2)用A表示2分钟内平均反应速率 ,A在第1分钟平均速率 第2分钟平均速率(填“<”、“>”、“=”)。
(3)容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为________(填“吸热”或“放热”)反应。
(4)为了增大B的转化率,可采取的措施是_________(用序号填空)
①加入A
②加入B
③加压
④再加入1.6 mol A+ 0.8 mol B
⑤将C分离出容器
(5)体积可变,维持容器压强和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是_________(用序号填空)
①4 mol A + 2 mol B
②3mol C + 1 mol D + l mol B
③3 mol C + 2 mol D
④1.6 mol A+ 0.8 mol B + 0.6 mol C + 0.2 mol D
(14分)(2011·温州高二检测)在25 ℃时,用石墨电极电解2.0 L 0.5 mol·L-1 CuSO4溶液。5 min后,在一个石墨电极上有6.4 g Cu生成。试回答下列问题:
(1)发生氧化反应的是________极,电极反应式为____________________________
________________________________________________________________________。
(2)若电解后溶液的体积不变,则电解后溶液的pH为________。
(3)若将溶液恢复到与电解前一样,则需加入________mol的________。
(4)若用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差________g,电解液的pH________。(填“变小”、“变大”或“不变”)
(12分)向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g) xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示: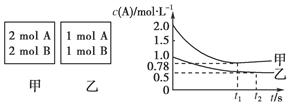
回答下列问题:
(1)乙容器中,平衡后物质B的转化率________;
(2)x=________;
(3)T ℃时该反应的平衡常数为________;
(4)下列说法正确的是________。
A.向平衡后的乙容器中充入氦气可使c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1
(12分)(2011·银川高二检测)化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列ΔH表示物质燃烧热的是________;表示物质中和热的是________。(填ΔH1、ΔH2和ΔH3等)
| A.2H2(g)+O2(g)===2H2O(l) ΔH1 |
| B.C(s)+O2(g)===CO(g) ΔH2 |
| C.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH3 |
| D.C(s)+O2(g)===CO2(g) ΔH4 |
E.C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l) ΔH5
F.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH6
G.2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l) ΔH7
(2)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单地理解为断开1 mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
| 化学键 |
P—P |
P—O |
O===O |
P===O |
| 键能kJ/mol |
197 |
360 |
499 |
x |
已知白磷(P4)的燃烧热为2 378.0 kJ/mol,白磷完全燃烧的产物(P4O10)的结构如图所示,则上表中x=________。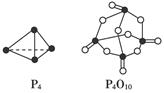
(18分)(2011·黄岗中学高二质检)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。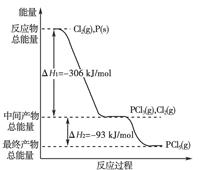
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是
________________________________________________________________________
________________________________________________________________________;
(2)PCl5分解成PCl3和Cl2的热化学方程式是__________________________________
________________________________________________________________________。
上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80 mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2________α1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是_________________________________________;
(4)P和Cl2分两步反应生成1 mol PCl5的ΔH3=________,P和Cl2一步反应生成1 mol PCl5的ΔH4______ΔH3(填“大于”、“小于”或“等于”);
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是
________________________________________________________________________。
(10分)根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是
________________________________________________________________________
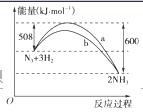
________________________________________________________________________。
(2)右图是198 K时N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为:______________________________________________________________________________________________________。