(1)营养平衡、科学使用食品添加剂有助于健康和提高免疫力。
①常用作食品防腐剂的是 。(填序号,下同)
a.苯甲酸钠 b.味精 c.柠檬黄
②维生素C能使碘水褪色,说明维生素C具有 。
a.易溶于水 b.酸性 c.还原性
③“中国居民平衡膳食宝塔”(见图),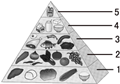
位于第“5”层且每天不超过25g的能量物质是 。
a.糖类 b.油脂 c.无机盐
(2)材料是人类文明的物质基础和先导,是直接推动社会发展的动力。
①玻璃、陶瓷、水泥的生产中,不需要使用石灰石作原料的是 (选填:“玻璃”、“陶瓷”、“水泥”)。
②氧气和四氯化硅蒸气在旋转的高温炉中反应(发生置换反应),其产物之一可制得光导纤维,该反应的化学方程式为 。
③易拉罐罐体成分为铝合金(含Al及少量的Fe、Cu及Mg等),
检验其中含铝元素的方法是: (写出化学方程式)。
(3)促进生态文明,保护生态环境,是实现“中国梦”的重要组成部分。
①水体富营养化主要是含有 (填元素符号)的物质排放引起的。
②安装汽车尾气催化转化装置可将汽车尾气中CO和NO转变为可参与大气生态环境循环的无毒气体,写出CO和NO在催化剂作用下反应的化学方程式 。
③提倡“光盘行动”,有利于“勤俭节约”、减少厨余垃圾,厨余垃圾的标识为 (选填序号)。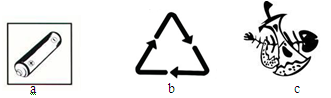
④ “封闭式焚烧”和“卫生填埋”是垃圾处理的最常用方法,含氯有机垃圾直接露天焚烧会产生一类剧毒有机物(含C、H、O、Cl),其名称为 。
⑤处理废水中重金属铊(Tl),需在废水中加入NaClO溶液,将Tl+转变为Tl3+,NaClO作 (选填:“氧化剂”、“还原剂”),同时加入熟石灰,将Tl3+转变为难溶物Tl(OH)3,最后加入明矾沉降除去,明矾作 。
某实验小组依据反应 设计如图1原电池,探究pH对AsO4 氧化性的影响。测得电压与pH的关系如图2。下列有关叙述不正确的是( )
设计如图1原电池,探究pH对AsO4 氧化性的影响。测得电压与pH的关系如图2。下列有关叙述不正确的是( )
| A.调节pH可以改变反应的方向 |
| B.pH=0.68时,反应处于平衡状态 |
| C.pH=5时, 负极电极反应式为2I--2e -= I2 |
| D.pH>0.68时,氧化性I2>AsO43- |
氧化剂和还原剂在生产生活中广泛使用。
(1)高锰酸钾和氢溴酸溶液可以发生如下反应:
2KMnO4+ 16HBr = 5Br2+ 2MnBr2+ 2KBr+ 8H2O
①其中还原剂为 ,还原产物为
②若有0.8 mol还原剂被氧化,则转移电子的物质的量是
(2)双氧水H2O2可作为矿业废液消毒剂,可以消除采矿业废液中的氰化物(如KCN,其中N为﹣3价),化学方程式为:KCN+H2O2+H2O═KHCO3+A↑(已配平)
①生成物A的化学式为
②用双线桥法表示该反应中电子转移的方向和数目:
(3)古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:
NaClO+ NH3·H2O 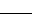 N2H4 + NaCl+ H2O
N2H4 + NaCl+ H2O
①请配平上述化学方程式
②NH3·H2O在上述反应中显示出来的性质是
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
(4)人体内所含铁元素以Fe2+和Fe3+的形式存在市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为 ,但Fe2+在酸性条件下很容易被空气中的氧气氧化,写出该反应的离子方程式
实验室现有一瓶2%氢氧化钠溶液(ρ="1.22" g/mL)。
(1)该氢氧化钠溶液的物质的量浓度为
(2)由于实验需要,现还需该浓度氢氧化钠溶液230 mL,需要临时配制。
①应选择 mL的容量瓶,容量瓶使用时第一步操作是
②需要的玻璃仪器除了容量瓶、量筒外,还有
③用托盘天平称取 g NaOH
④经过测定,某同学配制的氢氧化钠浓度偏高,则可能的原因是
| A.容量瓶中残存少量蒸馏水 |
| B.称取NaOH固体时,直接在纸片上称取 |
| C.溶解的NaOH溶液未冷却到室温,就转移到容量瓶中并定容 |
| D.洗涤烧杯内壁后将洗涤液弃去 |
E.定容时,俯视容量瓶刻度线
F.定容、摇匀后发现溶液的凹液面低于刻度线
(3)取该氢氧化钠溶液20 mL,加入0.5 mol/L硫酸溶液10 mL,然后把混合溶液稀释至100 mL,则稀释后的溶液中OH﹣的浓度为
A、B、C、D为四种可溶性的盐,它们包含的阳离子和阴离子分别为Ba2+、Ag+、Na+、Cu2+和NO3﹣、SO42﹣、Cl﹣、CO32﹣(离子在物质中不能重复出现)。
①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色;
②若向①的四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出.根据①②实验事实可推断它们的化学式为:
(1)A B
(2)写出盐酸与D反应的离子方程式:
(3)将含相同物质的量A、B、C的溶液混合后,写出溶液中存在的离子及物质的量之比 ;在此溶液中加入锌粒,写出发生反应的离子方程式
(4)C溶液中阴离子的检验方法:
现有下列九种物质:①HCl气体 ②Cu ③C2H5OH ④CO2 ⑤CuSO4 ·5H2O ⑥FeCl3固体 ⑦碘水 ⑧Ba(OH)2溶液 ⑨熔融Al2(SO4)3
(1)属于电解质的是 ;属于非电解质的是
(2)⑤在水中的电离方程式为
(3)171g ⑨溶于水配成500 mL溶液,SO42﹣的物质的量浓度为
(4)用洁净的烧杯取25 mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热得红褐色胶体,该反应的离子方程式为
(5)写出⑤的溶液和⑧反应的离子方程式
(6)要从⑦中提取纯净的碘,需要采取的操作有 、 、 (填写操作名称)