NA为阿伏加德罗常数,下列说法正确的是
| A.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
| B.标准状况下,22.4 L NH3中含有电子数为8NA |
| C.1 mol Cl2与足量Fe反应转移电子数为3NA |
| D.1 mol·L-1的AlCl3溶液中,Cl-的数目为3NA |
下列相关说法中,一定正确的是
| A.向盛有少量浓硝酸、稀硝酸的两支试管中,分别加入大小相同的铜片,可以证明浓硝酸氧化性强于稀硝酸 |
| B.用酸式滴定管向滴有酚酞的NaOH溶液中滴加标准HCl溶液,若滴入最后一滴HCl溶液后粉红色刚好褪去,说明已达滴定终点 |
| C.实验室配制480 mL 0.1 mol/L NaOH溶液,需要准确称量NaOH 1.920 g |
| D.铝箔在酒精灯火焰上加热时熔化但不滴落,是因为铝箔对熔化的铝有吸附作用 |
设NA表示阿伏加德罗常数,下列叙述中正确的是
①31g白磷含有的P—P键数为NA② 1molCH3+(碳正离子)中含有电子数为10NA③1mol铜与足量硫蒸气反应,转移电子数为2NA④用惰性电极电解CuCl2溶液,阴极析出32g铜时,线路中通过的电子数为NA⑤0.84 g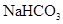 晶体中阳离子和阴离子总数为0.03NA⑥3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA⑦标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA
晶体中阳离子和阴离子总数为0.03NA⑥3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA⑦标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA
| A.①②④ | B.④⑥ | C.③④⑤ | D.④⑥⑦ |
氯仿可作为局部麻醉剂,常因保存不慎而被空气中的O2氧化,产生剧毒的气体-------光气(COCl2):2CHCl3+O2→2COCl2+2HCl。下列说法正确的是
| A.上述反应属于取代反应 |
| B.检验氯仿是否变质可选用的试剂是AgNO3溶液 |
| C.CH2Cl2有两种结构,说明CH4是正四面体结构 |
| D.CHCl3是常见的有机溶剂,大量使用对环境无影响 |
氧化还原反应实际上包含氧化和还原两个过程。(1)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O – 2e- → SO42- + 4H+; (2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2 + 2e- → 2Cl-。在(1)和(2)反应中均会生成产物X,则X的化学式为
| A.NaClO | B.NaClO4 | C.HClO | D.ClO2 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.由水电离产生的c(H+)=10-12mol/L的溶液:Na+、K+、NO3一、SO42一 |
| B.明矾溶液:K+、C1-、S2-、OH- |
| C.pH=1的溶液:Ag(NH3)2+、Fe3+、ClO4-、NO3- |
| D.能溶解Al2O3的溶液:Na+、Mg2+、HCO3-、SO42- |