反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在两升密闭容器中进行1分钟后,NH3减少了0.12 mol,则平均每秒钟浓度变化正确的是
| A.NO:0.001 mol·L-1 | B.H2O:0.002 mol·L-1 |
| C.NH3:0.002 mol·L-1 | D.O2:0.0025 mol·L-1 |
下列反应的离子方程式书写不正确的是()
| A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全: Ba2++2OH-+H++ SO42- + NH4+= BaSO4↓+ NH3•H2O+H2O |
| B.将少量SO2气体通入NaClO溶液中:SO2+H2O+ ClO-=SO42-+Cl-+2H+ |
C.硫化钠的水解:S2-+ H2O HS- + OH- HS- + OH- |
| D.NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-= CaCO3↓+2H2O+ CO32- |
近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的化学方程式为:KI+3H2O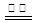 KIO3+3H2↑。下列有关说法不正确的是 ()
KIO3+3H2↑。下列有关说法不正确的是 ()
| A.电解转移3 mol e-时,理论上可制得KIO3 107 g |
| B.电解时, 石墨作阳极,不锈钢作阴极 |
| C.电解时的阳极电极反应式:I-−6e-+3H2O = IO3-+6H+ |
| D.电解过程中电解质溶液的pH变小 |
为达到相应的实验目的,下列实验的设计或操作最合理的是()
| A.为比较Cl与S元素的非金属性强弱,相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH值 |
| B.为观察Mg条在CO2气体中的燃烧,在一个集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部。 |
| C.为比较HA和HB两种弱酸的Ka大小,可用pH计测定同温同浓度的NaA溶液和NaB 溶液的pH值 |
| D.为测定一定浓度的NaOH溶液放置空气中是否部分转化为Na2CO3,用甲基橙作指示剂,用标准盐酸溶液滴定 |
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是( )
| A.在含等物质的量的AlO2-、OH-、CO32--的溶液中,逐滴加入盐酸:AlO2-、OH-、CO32- |
| B.在含等物质的量的FeBr2、Fel2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ |
| C.在含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2: KOH、Ba(OH)2、K2CO3、BaCO3 |
| D.在含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+ |
下列变化能够实现的是( )
①弱酸与盐溶液反应生成强酸②两种氧化物发生反应有气体生成
③两种酸的溶液充分反应后溶液呈中性④复分解反应中既没有生成水,也没有生成沉淀和气体
⑤两种无色气体常温常压下混合后气体颜色加深⑥有单质生成的非氧化还原反应
| A.全部 | B.只有①③⑤ | C.只有②④⑥ | D.只有①②③④ |