在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是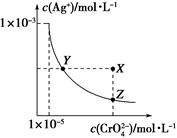
| A.t ℃时,Ag2CrO4的Ksp为1×10-11 |
| B.饱和Ag2CrO4溶液中加入K2CrO4能使溶液由Y点变为X点 |
| C.t ℃时,Y点和Z点时Ag2CrO4的Ksp相等 |
| D.t ℃时,将0.01mol·L-1AgNO3溶液滴入20mL0.01mol·L-1KCl和0.01mol·L-1K2CrO4的混合溶液中,Cl-先沉淀 |
人造地球卫星用到的一种高能电池——银锌蓄电池,它在放电时的电极反应为:Zn + 2OH– –2e–=ZnO + H2O,Ag2O + H2O + 2e–=2Ag + 2OH–,下列叙述中,正确的是
| A.Ag2O 是负极,并被氧化 |
| B.电流由锌经外电路流向氧化银 |
| C.工作时,负极区溶液pH减小,正极区pH增大 |
| D.溶液中OH-向正极移动,K+、H+向负极移动 |
1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为
| A.C + H2O ==CO + H2 ; ΔH==+131.3KJ·mol—1 |
| B.C(s)+ H2O(g) ==CO(g) + H2(g) ; ΔH==+10.94KJ·mol—1 |
| C.C(s)+ H2O(l) ==CO(g) + H2(g) ; ΔH==+131.3KJ·mol—1 |
| D.C(s)+ H2O(g) ==CO(g) + H2(g) ; ΔH==+131.3KJ·mol—1 |
以硫酸铜溶液作电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼。下列叙述正确的是
①粗铜与直流电源负极相连②阴极发生的反应为Cu2+ + 2e-= Cu
③电路中每通过3.01×1023个电子,得到的精铜质量为16 g
④杂质Ag以Ag2SO4的形式沉入电解槽形成“阳极泥”
| A.②③ | B.②④ | C.③④ | D.①③ |
常温下,纯水中存在电离平衡:H2O H++OH-。欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是
H++OH-。欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是
| A.H2SO4 | B.AlCl3 | C.NaHCO3 | D.NaOH |
下列各组离子能在PH=0的无色溶液中大量共存的是
| A.Mg2+、Cl-、Na+、SO42- | B.Ba2+、Na+、NO3-、MnO4- |
| C.K+、Cl-、HCO3-、NO3- | D.Ca2+、Na+、Fe3+、CO32- |