下列叙述正确的是
| A.常温时,某溶液中由水电离出来的c(H+)和c(OH一)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、A1O2-、SO42一 |
| B.常温时,0.1 mol/lHA溶液的pH>1,0.1 mol/lBOH溶液中c(OH一)/c(H+)=1012,将这两种溶液等体积混合,混合后溶液中离子浓度的大小关系为c(B+)>c(OH一)>c(H+)>c(A一) |
| C.过量SO2通入到Ba(NO3)2溶液中,反应的离子方程式为3SO2+2NO3-+3Ba2++2H2O=3BaS04 +2NO +4H+ |
| D.用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液,所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb |
有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为()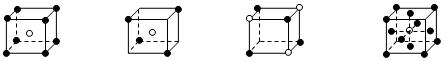
A B CD
下面有关晶体的叙述中,不正确的是()
| A.金刚石空间网状结构中,由共价键形成的碳原子环中,最小环上有6个碳原子 |
| B.氯化钠晶体中,每个Na+周围距离相等的Cl-共有6个 |
C.氯化铯晶体中,每个CS+周围紧邻8个 Cl- Cl- |
D.干冰晶体中,每个CO2分子周围紧邻10个C O2分子 O2分子 |
下列叙述中正确的是:()
| A.原子晶体中,共价键的键能越大,熔沸点越高 |
| B.分子晶体中,分子间的作用力越大,该分子越稳定 |
| C.分子晶体中,共价键的键能越大,熔沸点越高 |
| D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体 |
已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合。下列关于C3N4晶体的说法中正确的是()
| A.C3N4晶体是分子晶体 |
| B.C3N4晶体中,C-N键的键长比金刚石中的C-C键的键长要长 |
| C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子 |
| D.C3N4晶体中微粒间通过离子键结合 |
有四种氯化物,它们的通式为XCl2,其中最可能是第IIA族元素的氯化物是()
| A.白色固体,熔点低,完全溶于水,得到一种无色中性溶液,此溶液导电性差 |
| B.绿色固体,熔点高,易被氧化,得到一种蓝绿色溶液,此溶液具有良好的导电性 |
| C.白色固体,极易升华,如与水接触,可慢慢分解 |
| D.白色固体,熔点较高,易溶于水,得无色中性溶液,此溶液具有良好的导电性 |