在一容积不变的密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g) 2C(g);△H<0。达到平衡后,只改变一个条件(x),下列量(y)的变化一定符合图中曲线的是
2C(g);△H<0。达到平衡后,只改变一个条件(x),下列量(y)的变化一定符合图中曲线的是
| |
x |
y |
| A |
再加入A |
B的转化率 |
| B |
再加入C |
A的体积分数 |
| C |
增大体积 |
A的转化率 |
| D |
降低温度 |
混合气体的密度 |
下表是元素周期表的一部分,有关说法的组合中正确的是()
| 族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
| 2 |
a |
b |
|||||
| 3 |
d |
e |
f |
g |
h |
i |
①a、b、e、f四种元素的原子半径:e > f > b > a
②h、i两种元素阴离子的还原性:h > i
③a、g两种元素氢化物的稳定性:a > g
④d、e、f三种元素最高价氧化物对应水化物的碱性依次增强
⑤八种元素中d元素的单质还原性最强,i元素的单质氧化性最强
| A.①③④ | B.②③⑤ | C.②④⑤ | D.①③⑤ |
关于化学键的下列叙述中正确的是()
| A.离子化合物不可能含共价键 | B.共价化合物可能含离子键 |
| C.离子化合物中只含离子键 | D.共价化合物中不含离子键 |
以下烃中二氯代物只有两种的是()
| A.(CH3)2CHCH3 | B.CH3CH2CH3 | C.CH3CH2CH2CH3 | D.C(CH3)4 |
下列化学用语表达正确的是()
A.二氧化碳的电子式: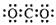 |
B.氯离子的结构示意图: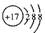 |
| C.乙烯的结构简式:C2H4 | D.质量数为18的氧原子: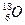 |
向淀粉中加入少量稀H2SO4,并加热。为了确定淀粉是否已水解或完全水解,所需下列试剂的组合正确的是()
①NaOH溶液,②银氨溶液,③新制Cu(OH)2碱性悬浊液,④碘水,⑤BaCl2
| A.①⑤ | B.②④ | C.①③④ | D.②③④ |