一定温度下,10mL0.40mol/L H2O2溶液发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
| t/min |
0 |
2 |
4 |
6 |
8 |
10 |
| V(O2)/mL |
0.0 |
9.9 |
17.2 |
22.4 |
26.5 |
29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
NA为阿伏加德罗常数,下列叙述中正确的是
①106 g Na2CO3晶体中的离子总数大于3NA
②标准状况下,16gO3和O2混合气体中含有的氧原子数为NA
③将0.1mol NaCl全部溶于乙醇中制成胶体,其中含有的胶体粒子数目为0.1NA
④1 mo1 N2和3 mol H2在一定条件下的密闭容器中充分反应,容器内的分子数大于2NA
| A.①② | B.②④ |
| C.①③ | D.③④ |
向三份均为100mL2mol/LNaHCO3溶液中,分别加入0.2g冰醋酸、0.1gCa(OH)2、0.3gNaAlO2固体(忽略溶液体积变化),则溶液中CO32-物质的量浓度的变化依次为()
| A.减小、减小、增大 | B.减小、增大、增大 |
| C.增大、减小、减小 | D.减小、减小、减小 |
下列反应的离子方程式书写不正确的是
| A.氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7: Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| B.氯气通入澄清石灰水中:Cl2+2OH-=Cl-+ClO-+H2O |
| C.用SO2还原含Cr2O72-的酸性废水:Cr2O72- + 3SO2 + 2H+ = 2Cr3+ + 3SO42-+ H2O |
| D.用小苏打治疗胃酸过多: CO32-+2H+=CO2↑+H2O |
分类是学习和研究化学的一种常用的科学方法。下列分类合理的是()
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤根据反应的热效应将化学反应分为放热反应和吸热反应
⑥根据分散剂的直径大小,分散系可分为溶液、胶体和浊液
| A.②⑤ | B.②③⑥ | C.①②④ | D.②③④⑤ |
已知:A为酸式盐,B为某二价主族金属元素的化合物,其中B的化学式中共有32个电子, 常温常压下C、D、F、G、I均呈气态 ,除G呈红棕色外其他气体均为无色。等物质的量A、B与少量的水充分混合能恰好完全反应。图中反应条件(除高温外)均已略去。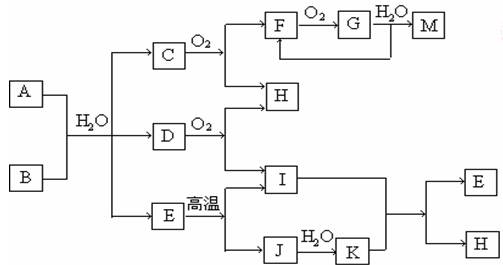
(2)写出A与B反应的化学方程式 。
(3)写出下列反应的离子方程式:
①在A溶液中加入M
②向A溶液中加入过量NaOH溶液,并加热
(4)C还可在纯氧中安静燃烧,产物为H和一种单质,写出该反应的化学方程式: