(共13分)I离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为 mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有 。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象, (填“能”或“不能”)说明固体混合物中无Fe2O3,理由是 (用离子方程式说明)。
II燃料电池(Fuel Cell)是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置。燃料和空气分别送进燃料电池,电就被奇妙地生产出来。它从外表上看有正负极和电解质等,像一个蓄电池,但实质上它不能“储电”而是一个“发电厂”。
(4)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置为用铂作为电极,加入电解质溶液中,其电池反应为4NH3+3O2=2N2+6H2O
写出该燃料电池的正极反应式
(5)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示。 
①放电时,负极的电极反应式为:
②假设装置中盛装100.0 mL 3.0 mol·L—1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8960 mL。放电完毕后,电解质溶液中各离子浓度的大小关系为:
(12分)反应aA(g)+bB(g) cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
回答问题:
(1)反应的化学方程式中,a:b:c为;
(2)A的平均反应速率vI(A)、vII(A)、vIII(A)从大到小排列次序为;
(3) B的平衡转化率aI(B)、aII(B)、aIII(B)中最小的是,其值是;
(4)由第一次平衡到第二次平衡,平衡移动的方向是,采取的措施是;
(5)比较第II阶段反应温度(T1)和第III阶段反应速度(T3)的高低:T2T3
填“>、=、<”判断的理由是;
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示IV阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C).
(10分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图: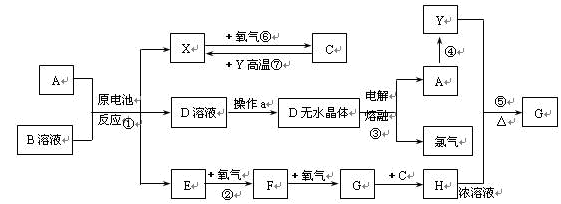
(注意:其中有些反应的条件及部分生成物被略去)
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为。
(2)从D溶液制备D的无水晶体的“操作a”为。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程为 。
(5)原电池反应①中正极的电极反应为。
(10分)⑴肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
⑵肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是 。
负极的电极反应式是 。
⑶右图是一个电化学过程示意图。
①锌片上发生的电极反应是 。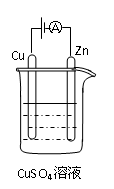
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变
化128g,则肼一空气燃料电池理论上消耗标准状况下的空气L
(假设空气中氧气体积含量为20%)
⑷传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反
应的离子方程式 。
(7分)用电石和水反应,产生的乙炔中含有H2S等杂质。某学生拟选用①NaOH溶液、②KMnO4溶液、③CuSO4溶液、④浓HNO3、⑤浓H2SO4中的一种除去H2S杂质,经研究最后他确定选用的溶液是 (填序号),如果没有该试剂,请你用其它试剂代替(写一种化学式) 。选用前者而发生的离子方程式为。但这一方程式所表示的制取原理与一般的情况有所不同,如强制弱、稳定制不稳定、难挥发制易挥发等,请用离子方程式表述将稀盐酸逐滴滴加到NaOH和Na2CO3混合溶液中的变化过程:。
(6分)利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖。在有机
物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物
分子中氢原子的种类和数目。例如乙醚的结构简式为:CH3—CH2—O—CH2—CH3
其核磁共振谱中给出的峰值 (信号)有两个,如下图所示:
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是
| A.CH3CH3 | B.CH3COOH | C.CH3COOCH3 | D.CH3OCH3 |
(2)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为: _____,请预测B的核磁共振氢谱上有个峰(信号)
_____,请预测B的核磁共振氢谱上有个峰(信号)