(7分)用电石和水反应,产生的乙炔中含有H2S等杂质。某学生拟选用①NaOH溶液、②KMnO4溶液、③CuSO4溶液、④浓HNO3、⑤浓H2SO4中的一种除去H2S杂质,经研究最后他确定选用的溶液是 (填序号),如果没有该试剂,请你用其它试剂代替(写一种化学式) 。选用前者而发生的离子方程式为 。但这一方程式所表示的制取原理与一般的情况有所不同,如强制弱、稳定制不稳定、难挥发制易挥发等,请用离子方程式表述将稀盐酸逐滴滴加到NaOH和Na2CO3混合溶液中的变化过程: 。
下图是两座工厂的主要生产流程以及它们之间的生产关系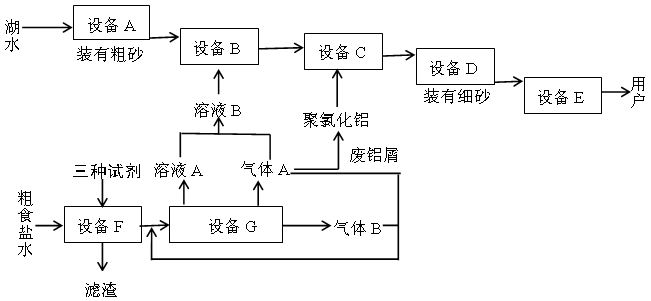
回答下列问题:
(1)与上图中“设备A”的作用相当的实验装置是。
(2)“溶液B”也可以用下列物质中的什么物质代替?。
a.KAl(SO4)2·12H2O b.ClO2 c.大量O3 d.K2Cr2O7e.活性炭
(3)聚氯化铝在生产过程中作剂,其作用是,可用离子方程式表示其化学原理如下(用Al3+代表聚氯化铝):。
(4)上图中下方的工厂主要生产两种气体和一种常见强碱,通常称为工业。
(5)加入“三种试剂”主要是为了除去粗食盐水中的Ca2+、Mg2+、SO42-等杂质,按加入的先后次序写出化学式。
(6)制取“溶液B”的方法现在已作了改进,其原理图,用离子方程式表示该装置中发生的反应:。
(1)下列化合物中熔点最高的是。
A.NaCl B.KBr C.NaF D.KI
(2)基态铬(Cr)原子的外围电子排布式是,这样排布使整个体系能量最低,原因是。
(3)氨水中存在多种形式的氢键,其中与“氨极易溶于水”这种性质相关的氢键可表示为:④。
下列各项中与氢键有关的是。
a.甘油与水互溶 b.HBr的沸点高于HCl c .邻羟基苯甲醛的熔点低于对羟基苯甲醛
d.水分子比硫化氢分子稳定 e.碘在乙醇中的溶解度较大,但不能用乙醇从碘水中萃取碘
(4)下列物质的晶体中含有阳离子的是,分子中存在π键的是,既含极性键又含非极性键的是。
A.K B.H2O2 C.CH3NH2 D.HCOONa E.F2C=CF2 F.CO2 G.C2HCl2Br
(5)下列各项的比较中正确的是。
A.第一电离能:Mg>Al B.电负性:P>Ge C.稳定性:AsH3>H2S D.金属性:20X<30Y
某有机物A有C、H、O三种元素组成,其蒸气密度是相同条件下的氢气密度的60倍,0.1molA在足量的氧气中充分燃烧后生成0.8molCO2和7.2克H2O;A可以发生银镜反应,其苯环上的一卤代物有三种。
(1)A中含氧官能团的名称是,A的结构简式为。
已知Ⅰ. 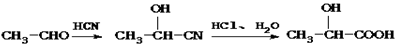
Ⅱ. 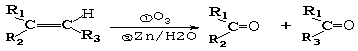
现有如下转化关系: ,其中D能使溴的四氯化碳溶液褪色,F继续被氧化成G,G 的相对分子质量为90。
,其中D能使溴的四氯化碳溶液褪色,F继续被氧化成G,G 的相对分子质量为90。
(2)C可能发生的化学性质有 (填选项)
A、能与氢气发生加成反应 B、能在碱性溶液中发生水解反应
C、能与甲酸发生酯化反应D、能与Ag(NH3)2OH发生银镜反应 E、能与氢氧化钠溶液反应
(3)C→D的反应类型为,G与足量小苏打溶液反应的化学方程式为。
(4)C的同分异构体有多种,写出符合下列条件的所有同分异构体的结构简式: ___________
①属于酯类化合物
②遇三氯化铁溶液显紫色
③与新制氢氧化铜悬浊液共热可生成红色沉淀
④苯环上的一卤代物只有一种
(5)聚乳酸 产品可以生物降解,实现在自然界中的循环,是理想的绿色高分子材料。请写出以2---丁烯(CH3CH=CHCH3)为原料制备聚乳酸的合成路线流程图(无机试剂任选用)。
产品可以生物降解,实现在自然界中的循环,是理想的绿色高分子材料。请写出以2---丁烯(CH3CH=CHCH3)为原料制备聚乳酸的合成路线流程图(无机试剂任选用)。
合成路线流程图示例如下 。
。
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)写出CO2与H2反应生成CH4和H2O的热化学方程式。
已知:① CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
② C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
③ 2CO(g) C(s)+CO2(g)ΔH=-171kJ·mol-1
C(s)+CO2(g)ΔH=-171kJ·mol-1
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:
①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2) / n(CO2)]变化的曲线图。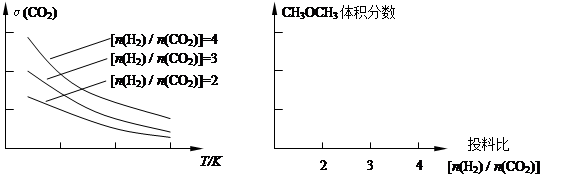
②某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是;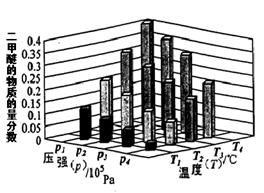
A. P3>P2,T3>T2B. P1>P3,T1>T3C. P2>P4,T4>T2D. P1>P4,T2>T3
③在恒容密闭容器里按体积比为1:3充入二氧化碳和氢 气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是;
A. 正反应速率先增大后减小
B. 逆反应速率先增大后减小
C. 化学平衡常数K值增大
D. 反应物的体积百分含量增大
E. 混合气体的密度减小
F. 氢气的转化率减小
(3)最近科学家再次提出“绿色化学”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出以稀硫酸为电解质甲醇燃料电池负极反应式__。以此燃料电池作为外接电源按图所示电解硫酸铜溶液,如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入(填物质名称),其质量约为g。
金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金。
(1)快中子反应堆的热交换剂用的是钠钾合金,其常温下是态(填气、液、固)。把钠的物质的量分数为20%的0.2mol的此合金安全地加入到重水(D2O)中,产生的气体物质所含的中子数为。
(2)镁铝合金是经常见到的轻质合金。剪一块合金在空气中燃烧,除生成MgO和Al2O3外,最有可能生成的第三种物质的电子式是。当一块5.1g的镁铝合金薄片溶于3.6 mol·L-1的200ml 的硫酸溶液中,至少需加入1 mol·L-1的氢氧化钠溶液的体积mL至沉淀质量不再改变,如整个过程中有0.5mol 的电子发生转移,则合金中Mg的物质的量分数为。
(3)①有一种铜的合金即黄铜(可看作是Cu和Zn),可分别用酸溶法或碱溶法来分离该两种金属,其中把该合金投入到稀盐酸中,发现产生气泡的速度比用锌与盐酸反应制氢气的速度快,其原因是。
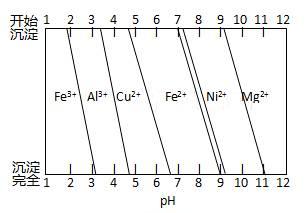
②为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。结合下图信息推断该合金中除铜外一定含有。