已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
| 元素 |
Al |
B |
Be |
C |
Cl[ |
F |
Li |
| X的数值 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
| 元素 |
Mg |
Na |
O |
P |
S |
Si |
|
| X的数值 |
1.2 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
|
试结合元素周期律知识完成下列问题:
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是______。
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系______________________________;简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系_____________________________________________。
(3)请你预测Br与I元素的X数值的大小关系________。
(4)某有机化合物分子中含有S—N键,你认为该共用电子对偏向于________原子(填元素符号)。
室温下取0.2 mol·L-1HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)①混合溶液中水电离出的c(H+)__________0.2mol·L-1 HCl溶液中水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=__________ mol·L-1c(H+)-c(MOH) =__________ mol·L -1
-1
(2)室温下如果取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度________MCl的水解程度。(填“>”、“<”、或“=”),溶液中各离子浓度由大到小的顺序为_______________________。
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。根据右图回答下列问题: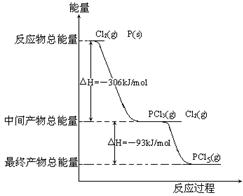
(1)P和Cl2反应生成PCl3的热化学方程式___________。
(2)PCl5分解成PCl3和Cl2的热化学方程式__________,
(3)P和Cl2分两步反应生成1molPCl5的△H3=______,P和Cl2一步反应生成1molPCl5的△H4_______△H3(填“大于”、“小于”或“等于”)。
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是_____________________。
化学平衡原理在工农业生产中发挥着重要的指导作用。
(1)反应C(s)+CO2(g)  2CO(g)平衡常数K的表达式为;
2CO(g)平衡常数K的表达式为;
已知C(s) + H2O(g) CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)
CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)  CO(g)+H2O(g)的平衡常数为K2 ,则K与K1、K2二者的关系为。
CO(g)+H2O(g)的平衡常数为K2 ,则K与K1、K2二者的关系为。
(2)已知某温度下,反应2SO2+O2 2SO3,的平衡常数K=19
2SO3,的平衡常数K=19
在该温度下的体积固定的密闭容器中,c0(SO2)=1mol·L-1,c0(O2)="1" mol·L-1,当反应在该温度 下SO2转化率为80%时,该反应(填“是”或“否”)达到化学平衡状态,若未达到,向(填“正反应”或“逆反应”) 方向进行。
下SO2转化率为80%时,该反应(填“是”或“否”)达到化学平衡状态,若未达到,向(填“正反应”或“逆反应”) 方向进行。
(3)对于可逆反应:aA(g) +bB(g)  cC(g)+dD(g)△H = a kJ·mol-1;若a+b>c+d,增大压强平衡向_______(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a_______0(填“>”或“<”)
cC(g)+dD(g)△H = a kJ·mol-1;若a+b>c+d,增大压强平衡向_______(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a_______0(填“>”或“<”)
已知多元弱酸在水溶液中的电离是分步进行的,且第一步电 离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度……
离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度……
今有HA、H2B、H3C三种一元、二元、三元弱酸,
根据“较强酸 + 较弱酸盐 = 较强酸盐 + 较弱酸”的反应规律,它们之间能发生下列反应:
① HA + HC2-(少量)= A- + H2C-;
② H2B(少量)+2A- = B2- + 2HA;
③ H2B(少量)+ H2C- = HB- + H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中酸性最强的是_________。
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最易结合质子(H+)的是_____,最难结合质子的是_____。
(3)完成下列反应的离子方程式
④ H3C + A-:_____________________;⑤ HB- + A-:______________________;
⑥ H3C + B2-:_____________________。
已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)  FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1 173 K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1 173 K情况下,K1、K2的值分别如下:
| 温度 |
K1 |
K2 |
| 973 K |
1.47 |
2.38 |
| 1173 K |
2.15 |
1.67 |
(1)通过表格中的数值可以 推断:反应①是(填“吸热”或“放热”)反应。
推断:反应①是(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)  CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=,根据反应①与②可推导出K1、K2与K3之间的关系式,据此关系式及上表数据,也能推断出反应③
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=,根据反应①与②可推导出K1、K2与K3之间的关系式,据此关系式及上表数据,也能推断出反应③ 是(填“吸热”或“放热”)反应。
是(填“吸热”或“放热”)反应。
(3)要使反应③在一定条件下建立的平衡向正反应方向移动同时υ正增大可采取的措施
有(填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂 E.设法减小平衡体系中的CO的浓度
(4)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
①图甲中t2时刻发生改变的条件是。②图乙中t2时刻发生改变的条件是。
(5)在830℃温度下,反应③的K值为1,在2 L的密闭容器中,加入1 mol CO2和3 mol H2充分反应达平衡时,CO平衡浓度为mol/L。H2转化率。若向容器中再加入1 mol CO2和3 mol H2 达到平衡后CO平衡浓度mol/L ,CO2体积分数