(14分)亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3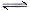 H++ H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
H++ H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式 。
②根据亚磷酸(H3PO3)的性质可推测Na2HPO3稀溶液的pH 7(填“>”、“<”或“=”)。
③某温度下,0.1000 mol·L-1的H3PO3溶液中c (H+)=2.5×10-2mol·L-1,除OH—之外其他离子的浓度由大到小的顺序是 ,该温度下H3PO3电离平衡的平衡常数K= 。(H3PO3第二步电离忽略不计,结果保留两位有效数字)
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式 。
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为 。
②产品室中生成亚磷酸的离子方程式为 。
Ⅰ.2011年11月28日至12月9日,联合国气候变化框架公约第17次缔约方会议在南非德班召开,随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3.25 mol H2,在一定条件下发生反应,测定CO2、CH3OH(g)和H2O (g)的浓度随时间变化如图所示:
①写出该工业方法制取甲醇的化学反应方程式 。
②从反应开始到平衡,氢气的平均反应速率v (H2)= 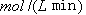 。
。
③该条件下CO2的转化率为 。当温度降低时CO2的转化率变大,则该反应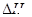 0(填“>”“<”或“=”)。
0(填“>”“<”或“=”)。
④下列措施中能使n(CH3OH)/n(CO2)增大的是 。
| A.升高温度 | B.充入氮气 |
| C.将水蒸气从体系中分离 | D.用更有效的催化剂 |
(2)选用合适的合金作为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极的电极方程式为 。
Ⅱ.研究NO2 、SO2 、CO等大气污染气体的处理具有重要意义。其中氮元素有着多变价态和种类多的化合物,它们在工农业生产、生活中发挥着重要的作用。完成下列问题:
(1)已知:2SO2(g) + O2(g) 2SO3(g)ΔH=" —196.6" kJ·mol―1
2SO3(g)ΔH=" —196.6" kJ·mol―1
2NO(g) + O2(g) 2NO2(g) ΔH=" —113.0" kJ·mol―1
2NO2(g) ΔH=" —113.0" kJ·mol―1
则反应NO2(g) + SO2(g) SO3(g) + NO(g) 的ΔH= 。
SO3(g) + NO(g) 的ΔH= 。
(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,
①下列能说明反应达到平衡状态的是 (填序号) 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.相同时间内,每消耗1 molNO2的同时消耗1 mol SO3
②当测得上述反应平衡时NO2与SO2体积比为1: 6,则平衡常数K= 。
【改编】现有A、B、C、D四种短周期主族元素,其原子序数依次增大。已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。请回答下列问题:
(1)元素D在周期表中的位置是________________________。
(2)C2B2晶体中阴阳离子个数比为__________;请写出C2B2与A2B反应的化学方程式____________。
(3)元素B、C形成的简单离子中半径较大的是_________(写电子式)。
(4)C2D的溶液中各离子浓度由小到大的关系为 。
(5)如图所示以铂作电极,以C、D两元素的最高价氧化物的水化物X、Y的溶液作为电解质溶液,A、B元素的单质分别在两电极上发生原电池反应,则通入A单质的电极反应式为_________,通入B单质的X溶液的pH将__________(填“增大”、“不变”或“减小”)。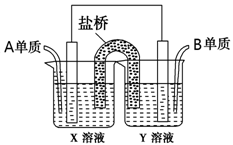
[化学——选修5:有机化学基础]以甲苯为原料可以合成某种食用香料(有机物G)和某种治疗肺结核药物的有效成分(有机物PAS-Na)的路线如下:

回答下列问题:
(1)由B生成C的反应类型是 。
(2)肉桂酸中含氧官能团的名称是 。
(3)写出由A生成B的化学方程式: 。
(4)质谱图显示试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,写出肉桂酸与试剂b生成G的化学方程式: 。
(5)当试剂d过量时,可以选用的试剂d是 (填字母序号)。
a.NaOH b.Na2CO3 c.NaHCO3
(6)写出C与NaOH反应的化学方程式: 。
(7)在肉桂酸分子中碳碳双键催化加氢后得到化合物X(分子式为C9H10O2),X有多种同分异构体,符合下列条件的有 种。
a.苯环上有两个取代基;
b.能发生银镜反应;
c.与Na作用有H2产生
[化学——选修3:物质结构与性质]已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族。 E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 。
(2)E2+离子的价层电子排布图是 ,F原子的电子排布式是 。
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,B元素的气态氢化物的VSEPR模型为 。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 。
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程为 。
(6)某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度d= g/cm3。(保留两位小数)
尿素[CO(NH2)2]是首个由无机物人工合成的有机物。工业上合成尿素的反应如下:
2NH3(g)+CO2(g)  CO(NH2)2(l) + H2O (l)ΔH<0。回答下列问题:
CO(NH2)2(l) + H2O (l)ΔH<0。回答下列问题:
已知工业上合成尿素分两步进行,相关反应如下:
反应Ⅰ:2NH3(g)+CO2(g)  NH2COONH4(s)ΔH1<0
NH2COONH4(s)ΔH1<0
反应Ⅱ:NH2COONH4(s)  CO(NH2)2(l)+ H2O (l)ΔH2>0
CO(NH2)2(l)+ H2O (l)ΔH2>0
(1)下列示意图中[a表示2NH3(g)+CO2(g),b表示NH3COONH4(s),c表示CO(NH2)2(l)+H2O(l)],能正确表示尿素合成过程中能量变化曲线是(填序号) 。
(2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如下图所示。
从图中得知∆c(CO2)=0.2mol/L,则v(CO2)= ∆c(CO2)/t= 0.01mol·L-1·min-1。
①在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为 。
②为提高尿素的产率,下列可以采取的措施有 。
| A.缩小反应容器的容积 |
| B.升高温度 |
| C.平衡体系中及时分离出CO(NH2)2 |
| D.使用合适的催化剂 |
③该反应的平衡常数表达式K= ;若升高体系的温度,容器中NH3的体积分数将 (填“增加”、“减小”或“不变”)。
④若保持平衡的温度和体积不变,25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在上图中画出25~50min内氨气的浓度变化曲线。