草酸晶体的组成可表示为:H2C2O4·xH2O,实验室常用其加热分解制取CO气体,反应的化学方程式为:H2C2O4·xH2O  CO↑+CO2↑+(x+1)H2O,将生成的CO2和水蒸气除掉,即得到较纯净的CO气体。
CO↑+CO2↑+(x+1)H2O,将生成的CO2和水蒸气除掉,即得到较纯净的CO气体。
Ⅰ、下图是除去草酸分解产物中的CO2、水蒸气后得到CO,并用CO还原两通管中的CuO实验装置,回答下列问题。
(1)在甲洗气瓶中所盛溶液是 。
(2)CuO全部被还原后停止实验操作的步骤的有:①停止通气体,②熄灭酒精灯,③拆下实验装置,④继续通气体到两通管冷却止。其正确的操作顺序是 。
A.④②①③ B.①②③ C.②④①③ D.②④③
Ⅱ、为测定草酸晶体的x值,进行下列实验:
①取wg草酸晶体配成100mL水溶液;
②量取25.00mL草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol·L-1KMnO4溶液滴定。滴定时,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
请回答下列问题:
(1)实验②中,滴定时,KMnO4溶液应装在 (填“酸式滴定管”、“碱式滴定管”)中。
(2)判断滴定终点的方法是 。若滴定时,前后两次读数分别为a mL和b mL,由此计算出该草酸晶体的x值是 。
(3)下列操作会引起测得的x值偏大的是 (填选项)
A.滴定结束时俯视读数
B.滴定结束后滴定管尖嘴处还有一滴标准液悬而未滴
C.锥形瓶未干燥即装入草酸溶液
D.滴定管用蒸馏水洗净后即装入KMnO4溶液
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
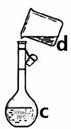
I II
⑴写出下列仪器的名称:
a. b. c.
⑵仪器a~e中,使用前必须检查是否漏水的有。(填序号)
⑶若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是,将仪器补充完整后进行实验,温度计水银球的位置在处。冷凝水由(填f或g)口通入,口流出。
现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是。除了图中给出的的仪器和分析天平外,为完成实验还需要的仪器有:。
②根据计算得知,所需NaOH的质量为g
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ________。
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
CCl4和蒸馏水都是无色溶液,请按下列要求用实验方法鉴别:
(1)只允许用一种试剂:用两支试管分别取出少量的CCl4和蒸馏水,然后分别加入少量的单质碘,振荡,呈紫红色的液体是__________,呈棕黄色的液体是__________。
(2)不用任何试剂:用试管取出少量的其中一种液体,再加入另外一种液体,下层液体是__________,上层液体是__________。
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。查阅相关资料获悉: a.四氯化硅遇水极易水解;
b.铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 |
SiCl4 |
AlCl3 |
FeCl3 |
PCl5 |
| 沸点/℃ |
57.7 |
— |
315 |
— |
| 熔点/℃ |
-70.0 |
— |
— |
— |
| 升华温度/℃ |
— |
180 |
300 |
162 |
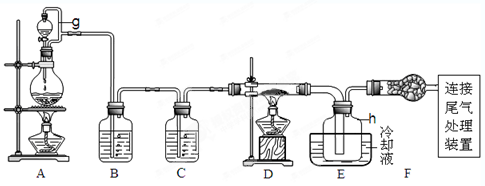
请回答下列问题:
(1)写出装置A中发生反应的离子方程式。
(2)装置A中g管的作用是;装置C中的试剂是;装置E中的h瓶需要冷却理由是。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,含有铁、铝等元素的杂质。为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原反应滴定,锰元素被还原为Mn2+。
①写出用KMnO4滴定Fe2+的离子方程式:;
②滴定前是否要滴加指示剂?(填“是”或“否”),判断滴定终点的方法是。
③某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是。若滴定前平视,滴定后俯视KMnO4液面,对测定结果有何影响(填“偏高”、“偏低”、或“无影响”)
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。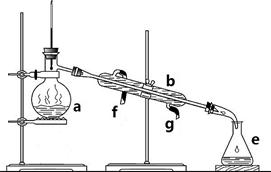
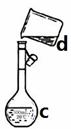
I II
⑴写出下列仪器的名称:
a. b. c.
⑵仪器a~e中,使用前必须检查是否漏水的有。(填序号)
⑶若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是,将仪器补充完整后进行实验,温度计水银球的位置在处。冷凝水由(填f或g)口通入,口流出。
(4)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是。除了图中给出的的仪器和分析天平外,为完成实验还需要的仪器有:。
②根据计算得知,所需NaOH的质量为g
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ________。
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中 |
| D.将容量瓶盖紧,反复颠倒摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
为了配制100 mL 1 mol/L NaOH 溶液,其中有下列几种操作,错误的操作是________(填标号)。
①选刚用蒸馏水洗净过的100 mL 容量瓶进行配制
②NaOH 固体在烧杯里刚好完全溶解,立即把溶液转移到容量瓶中
③用蒸馏水洗涤烧杯内壁两次,洗涤液都移入容量瓶中
④使蒸馏水沿着玻璃棒注入容量瓶,直到溶液的凹液面恰好跟刻度相切
⑤由于不慎,液面超过了容量瓶的刻度线,这时采取的措施是使用胶头滴管吸出超过的一部分