某同学查阅教材得知,普通锌锰电池筒内无机物质主要成分为MnO2、NH4Cl、ZnCl2等物质。他在探究废干电池内的黑色固体回收利用时,进行如图所示实验:下列有关实验的叙述中,不正确的是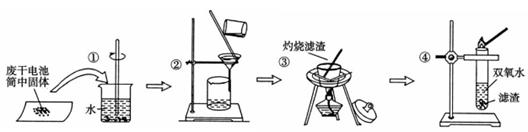
| A.操作①中玻璃棒的作用是加快固体溶解速度 |
| B.操作②的操作名称是过滤 |
| C.操作③中盛放药品的仪器是坩埚 |
| D.操作④的目的是除去滤渣中杂质 |
常温下,下列溶液的pH或微粒的物质的量浓度关系不正确的是()
A.某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a
B.某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度一定是
c(Na+) >c(S2-) >c(OH-) >c(HS-) >c(H+)
C.pH=3的二元弱酸H2R溶液与 pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)+ c(HR-)=c(Na+)
D.将0.2 mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH-)=2c(H+)+c(HA)-c(A-)
向含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是()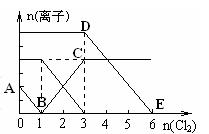
| A.线段BC代表Fe3+ 物质的量的变化情况 |
| B.原混合溶液中n(FeBr2)= 6mol |
| C.当通入Cl22mol时,溶液中已发生的离子反 应可表示为:2Fe2++2I━+2Cl2=2Fe3++I2+4Cl━ |
| D.原溶液中n(Fe2+): n(I━): n(Br━)=2:1:3 |
水的电离平衡曲线如右图所示,下列说法不正确的是()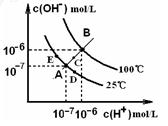
A.图中五 点KW间的关系:B>C>A=D=E 点KW间的关系:B>C>A=D=E |
| B.若从A点到D点,可采用:温度不变在水中加入少量的酸 |
| C.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体。 |
| D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合 |
后,溶液显酸性
对于①ag纯净的Na2CO3,②ag Na2CO3和NaHCO3的混合物;下列各种情况的描述正确的是()
| A.与足量盐酸反应时,②放出的CO2多 | B.与盐酸反应时,②消耗盐酸多 |
| C.配成等体积的溶液,②的pH大 | D.配成等体积的溶液,②的c(Na+)大 |
以任意比例将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
| A.②③④ | B.②③④⑤ | C.①③④ | D.①②③④ |
| 序号 |
甲 |
乙 |
丙 |
| ① |
CO2 |
SO2 |
石灰水 |
| ② |
HCl |
CO2 |
石灰水 |
| ③ |
CO2 |
SO2 |
B a(NO3)2 a(NO3)2 |
| ④ |
NO2 |
SO2 |
BaCl2 |
| ⑤ |
CO2 |
NH3 |
CaCl2 |