海洋中资源丰富,以海水为原料可制得一系列产品,如下图所示:
下列有关说法正确的是
| A.第①步除去粗盐SO42-、Ca2+、Mg2+、Fe3+等杂质离子,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
| B.将第②步结晶出的MgCl26H2O在空气中加热分解制备无水MgCl2 |
| C.在第③④⑤步中溴元素均被氧化 |
| D.电解饱和食盐水时,在阴极区生成NaOH |
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是()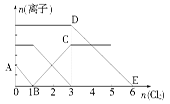
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中c(FeBr2)=6 mol/L |
| C.当通入Cl2 2 mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 |
氯气是一种重要的工业原料。工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是()
| A.若管道漏气遇氨就会产生白烟 |
| B.该反应利用了Cl2的强氧化性 |
| C.该反应属于复分解反应 |
| D.生成1 mol N2有6 mol电子转移 |
氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是()
| A.再通入少量氯气,c(H+)/c(ClO-)减小 |
| B.通入少量SO2,溶液漂白性增强 |
| C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-) |
| D.加入少量固体NaOH,溶液的pH会略微增大 |
有一瓶无色气体可能含有CO2、HBr、NO2、HCl、SO2中的一种或几种。将此气体通入足量稀氯水中,恰好完全反应,得无色透明溶液,把此溶液分成两份,分别加入盐酸酸化了的BaCl2溶液和硝酸酸化了的AgNO3溶液,均出现白色沉淀,以下结论正确的是()
| A.不能确定原气体中是否含有SO2 |
| B.原气体中肯定有HCl |
| C.原气体中肯定没有CO2 |
| D.原气体中肯定没有HBr、NO2 |
某同学用下列装置制备并检验Cl2的性质。下列说法正确的是()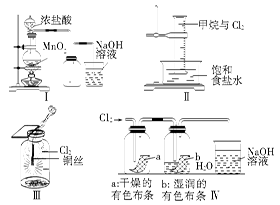
| A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗 |
| B.Ⅱ图中:量筒中发生了加成反应 |
| C.Ⅲ图中:生成蓝色的烟 |
| D.Ⅳ图中:湿润的有色布条能褪色 |