下列有关实验现象和解释或结论都正确的是
| 选项 |
实验操作 |
实验现象 |
解释或结论 |
| A |
将充满NO2的密闭玻璃球浸泡在热水中 |
红棕色变深 |
反应2NO2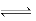 N2O4的 N2O4的 H<0 H<0 |
| B |
将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 |
下层分别呈无色和紫红色 |
还原性:I->Br->Fe2+ |
| C |
某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 |
有白色沉淀出现 |
该钾盐是K2CO3 |
| D |
把SO2通入紫色石蕊试液中 |
紫色褪去 |
SO2具有漂白性 |
进行化学实验必须注意安全,下列说法不正确的是
| A.不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| B.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 |
| C.从煤油中取用金属钠必需用镊子,不能用手触摸 |
| D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
在恒容条件下发生反应A(g)+3B(g) 2 C(g)(△H<0),改变其他反应条件,在Ⅰ、Ⅱ阶段体系中各物质浓度随时间变化的曲线如下图所示,下列说法中正确的是
2 C(g)(△H<0),改变其他反应条件,在Ⅰ、Ⅱ阶段体系中各物质浓度随时间变化的曲线如下图所示,下列说法中正确的是
A.第Ⅰ阶段用C表示的平衡前的反应速率v (C)=0.1 mol/(L·s)
B.第Ⅱ阶段中B的平衡转化率αⅡ(B)为0.019
C.第Ⅰ阶段的平衡常数KⅠ与第Ⅱ阶段平衡常数KⅡ的大小关系是:KⅠ﹤KⅡ
D.由第一次平衡到第二次平衡,可能采取的措施是从反应体系中移出产物C
下列叙述错误的是
| A.已知在常温下醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol·L-1 |
| B.把物质的量浓度相等的盐酸和醋酸溶液分别稀释m倍和n倍,欲使稀释后两溶液的pH相同,则m>n |
| C.常温下,某溶液中由水电离出来的c(OH-)=1.0×10-12 mol·L-1,则该溶液的PH可能是2或12 |
| D.用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液,酸碱恰好完全反应时所得溶液的pH=7,因为5<7<8,在石蕊的变色范围内,所以选择石蕊作为指示剂 |
下列说法正确的是
| A.pH=6的溶液一定是酸性溶液 |
| B.在等温等压条件下,能自发进行的化学反应,不一定是△H﹤0、△S﹥0 |
| C.吸热反应一定需要加热才能发生,放热反应都能自发进行 |
| D.弱电解质的电离常数既与弱电解质的性质和温度有关,也与溶液中的离子浓度有关 |
常温下,有下列四种溶液:①pH=2的HCl溶液;②pH=2的CH3COOH溶液;③pH=12的NaOH溶液;④pH=12的氨水。下列有关说法不正确的是
| A.将等体积的四种溶液分别稀释100倍,所得溶液的pH:③>④>②>① |
| B.取体积相同的溶液①、②、③分别与足量铝粉反应,生成H2的量:①最少 |
| C.四种溶液中的KW相同,由水电离出的c(H+):①=②=③=④ |
| D.将VaL溶液①与VbL溶液③混合后,若混合后溶液pH=3,则Va∶Vb=11∶9 |