硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域。
(1)三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性的无色有毒腐蚀性气体,其分子的立体构型为 ,B原子的杂化类型为 。
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。下图是磷化硼晶体的晶胞示意 图,则磷化硼的化学式为 ,该晶体的晶体类型是 。
(3)硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3B03分子间通过氢键相连(如图)。
①硼酸分子中B最外层有 个电子,1 molH3B03的晶体中有 mol氢键。
②硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2 O,它电离生成少量[B(OH)4]一和H+,则硼酸为 元酸,[B(OH)4]一含有的化学键类型为 。
(4)H3P04的K1、K2、K3分别为7.6×10-3、6.3×10-8、4.4×10-13,硝酸完全电离,而亚硝酸K=5.1×10-4, 请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因 ;
②硝酸比亚硝酸酸性强的原因 。
(5)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为a cm,则该晶体中距离最近的两个阳离子核间的距离为 (用含有a的代数式表示)。在一定温度下,NiO晶体可以自发地分散并形成“单分子层”(如图)
可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为
g(氧离子的半径为1.40×10-10m,  1.732)。
1.732)。
工业上从海水中提取溴可采用如下方法:
(1)向海水中通入Cl2,将海水中的溴化物氧化,其离子方程式为__________。
(2)向上述混合液中吹入热空气,将生成的溴吹出用纯碱溶液吸收,其化学方程式为______________________________________________。
(3)将(2)所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂提取溴后还可得到副产品Na2SO4。写出这一过程的化学方程式__________________。
(4)这样得到的溴中还混有少量Cl2,怎样除去(用离子方程式表示)____________。
在KI 淀粉溶液中,滴加少量Na2ClO溶液,并加入少量稀H2SO4,溶液立即变蓝,这是因为____________,离子方程式是________________。
在上述蓝色的溶液中滴加足量的Na2SO3溶液,蓝色逐渐消失,这是因为_________,离子方程式是________________________________________。
从以上实验可知,ClO-、I2、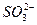 的氧化性由强到弱的顺序是_________________________。
的氧化性由强到弱的顺序是_________________________。
多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性质与Cl2相似,它们也和Cl2一样可以生成酸和盐。见下表:
| 项目 |
氯气 |
氰 |
硫氰 |
① |
| “单质” |
Cl2 |
(CN)2 |
(SCN)2 |
(OCN)2 |
| 酸 |
HCl |
HCN |
② |
HOCN |
| 盐 |
KCl |
KCN |
KSCN |
③ |
(1)在表中①②③处应分别填写、、。
(2)完成下列化学方程式:
①HSCN+MnO2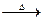
②(CN)2+H2O——
③(OCN)2+KOH——
A、B、C、D和E五瓶溶液分别是HCl、CaCl2、Na2CO3、AgNO3、KI溶液中的一种,现将瓶内溶液各取少许进行两两混合实验,如果如下图所示,图中“↓”“↑”和“-”分别表示生成沉淀、气体和无明显变化,请根据实验现象判断各瓶内所装的溶液是A,B,C,D,E。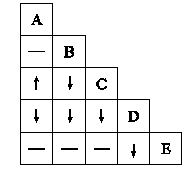
如图4-9,硬质玻璃管内,左、中、右分别放有3个湿润棉花球;a球浸有溴化钾溶液;b球浸有碘化钾浓溶液;c球中浸有KI淀粉溶液。实验时,从右端缓缓通入氯气,同时在b处微热,并逐渐向左移动酒精灯,则可以观察到: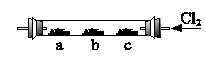
图4-9
(1)在a处有产生。
(2)在b处有色产生。
(3)c处变成色。
(4)稍冷却后,b、c之间的管壁上有色的。