(1)普通玻璃又称为钠玻璃,试写出生产普通玻璃过程中发生反应的一个化学方程式: 。
(2)实验室用于盛放碱性试剂的试剂瓶不用磨口玻璃塞的原因是(用离子方程式表示): ;玻璃试剂瓶不能盛放氢氟酸的原因是(用化学方程式表示): 。
(3)有一种特殊玻璃为钾玻璃,其热膨胀系数较小,较难熔化,较难受化学药品的侵蚀,可用于制作一般的化学仪器。现以石英砂、苛性钾、熟石灰为原料,熔制钾玻璃,质量比为75:28:37(假定这些原料不含杂质),试用氧化物的形式表示该钾玻璃的组成 。
(4)下列叙述正确的是 。
①SO2、NO、NO2都是形成酸雨的因素,都能和水反应生成酸
②NH3、H2S均不能用浓硫酸干燥
③水晶的主要成分是SiO2
④SiO2与CO2都属于酸性氧化物,都不能与酸反应
⑤实验室可用NaOH溶液处理Cl2和SO2废气
⑥NO只能用排水集气法收集,不能用排空气法收集;而NO2只能用排空气法收集,不能用排水集气法
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各
元素中电负性最大。请回答下列问题:
(1) X、Y的元素符号依次为 (1分)、 (1分);
(2) XZ2与YZ2分子的立体结构分别是V形(1分)和直线形(1分),相同条件下两者在水中的溶解度较大的是 (1分)(写分子式)’理由是因为 (2分);
(3) Q的元素符号是 (1分),它属于 周期,它的核外电子排布式为 (1分),在形成化合物时它的最髙化合价为 (1分);
(4) 用氢键表示式写出£的氢化物溶液中存在的所有氢键 (4 分)。
分析下面两个案例并回答有关问题。
(1) 某城镇生产、生活的分布情况如图所示,河流中W、X、Y、Z处某次水样抽测结果如表所示。
①导致X、Y处水样pH变化的原因可能是
②Z处鱼类大量减少,产牛这种现象的原因可能是(3分),
(2) 某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2Qi,还含有SiO2等杂质)、煤矿、石灰石和黏土。拟在该地区建设大型炼铁厂。
①随着铁矿的开发和炼矿的鼓厲要在该地区相应建立焦化厂、发电厂、水泥厂等,形成规模的工业体系。据此确定上图中相应工厂的名称A、B焦化厂、C、D(每空1分)>
②以赤铁矿为原料,写出髙炉炼铁中得到生铁和产生炉渣的化学方程式
(2 分),
③从“三废”利用、环境保护等角度考虑,该地区和企业在生产中应采取的一些措施有(举出2种措施即可)(3分),
工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。
(1) 右图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是;NaOH溶液的出口为______(填字母);精制饱和食盐水的进口为_____(填字母);干燥塔中使用的液体干燥剂是____(每空2分)。
(2) 原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加人的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是(2分)(填序号)。
(3) 多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为(2分)。 也可转化为
也可转化为 而循环使用。一定条件下,在200C恒容密闭容器中发生反应:
而循环使用。一定条件下,在200C恒容密闭容器中发生反应: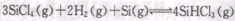 ,达平衡后,H2与SiHCL3物质的量浓度分别为0. 140mol/L和0. 020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的物质的量为_______ (2分)mol。
,达平衡后,H2与SiHCL3物质的量浓度分别为0. 140mol/L和0. 020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的物质的量为_______ (2分)mol。
(4)已知1 g阴极产生的气体在阳极产生的气体中完全燃烧时放出92. 3 kj的热量,则该反应的热化学方程式为: (2分)。
A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最髙价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4 : 1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为
2 : 1的离子化合物丙。
(1) D的原子结构示意图为(1分),丙的电子式为,E在周期表中的位置为(2分)。
(2) 下列说法正确的有(2分)。
①化合物乙为正四面体形分子,是由极性键构成的非极性分子
②C、D、E、F原子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
④化合物甲和化合物丙都含有离子键和共价键
(3) 已知通常状况下1gF在空气中完全燃烧放出a kj的热量,请写出表示F燃烧热的热化学方程式(2分)。将燃烧产物通入BaCl2和HNO3的混合溶液,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应(2 分)。
(4) 写出一个由以上元素构成的1Oe-微粒与18e-微粒反应的离子方程式:
(2分)及其他合理答案。
如图,有甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充人lmdA、3molB,此时两容器体积均为500mL,温度为T0C保持温度不变发生反应:

(1) 下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是__ __(2分,全才得分)。
A.混合气体的总质量不随时间改变B 2V正(C)=3V逆(B)
C. A、B转化率相等D.物质D的质量不随时间改变
(2) 2minn后甲容器中反应达到平衡,测得C的浓度为2mol/L,此时容器的体积为____(2分)mL,B的转
化率a甲(B)为____ (2分)。
(3) 乙容器中反应达到平衡所需要的时间____2min(2分)(填“>”、“<”或“=”,下同),B的转化率a乙(B)为___ a甲(B) (2分)。
(4) 其它条件不变,甲中如果从逆反应方向开始建立平衡,要求平衡时C的物质的量与(2)中平衡时C的物质的量相等,则需要加人C的物质的量n(C)为____ (2分)mol,加人D的物质的量n(D)应该满足的条件为(2分)。