称取Na2CO3、NaHCO3固体各2g,分别加入两只大试管中,再各加10mL蒸馏水,充分溶解后各滴入2滴酚酞溶液,观察到下图所示现象。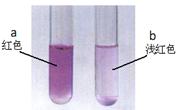
下列说法中正确的是
| A.试管a溶解过程中温度下降 |
| B.试管b中放入的是NaHCO3固体 |
| C.两试管中水的离子积常数:a<b |
| D.对比液体颜色可知常温下水解程度:CO32->HCO3- |
已知某有机物C6H12O2酸性条件下能发生水解反应生成A和B,B能氧化成C,若A、C都能发生银镜反应,则C6H12O2符合条件的结构简式有(不考虑立体异构)
A.3种 B.4种 C.5种 D.6种
某有机物X含碳、氢、氧三种元素.欲确定X的分子式,所需下述条件中的最少组合是
①含碳的质量分数②含氢的质量分数③蒸气的摩尔体积(折合成标准状况下的体积)
④X对H2的相对密度(同温同压)⑤X的质量⑥X的沸点
| A.①②③④⑥ | B.①③⑥ | C.①②④ | D.①② |
以下实验:①为检验RX是碘代烷,将RX与NaOH水溶液混合后再加入AgNO3溶液;②实验室里用无水乙醇和浓硫酸共热至140℃制乙烯;③用锌与稀硝酸反应制取氢气,并用排水法收集氢气;④在试管中加入2mL 10%的CuSO4溶液,滴入2%的NaOH溶液4~6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾;⑤为检验淀粉已水解,将淀粉与少量稀硫酸加热一段时间后再加入银氨溶液,水浴加热;其中可能失败的实验是
| A.①②③④⑤ | B.①②④⑤ | C.②③④⑤ | D.②③⑤ |
有一种有机物的结构简式如图,下列关于它的性质的叙述,正确的是
①它有弱酸性,能与氢氧化钠反应;
②它不能发生水解反应;
③它能发生水解反应,水解后生成两种物质;
④它能发生水解反应,水解后只生成一种物质
| A.只有① | B.只有①② | C.只有①③ | D.只有①④ |
下列关于有机化合物1和2的说法正确的是
| A.有机物1和2互为同分异构体 |
| B.有机物1和2在氢氧化钠的乙醇溶液中均可发生消去反应 |
| C.有机物1和2中所有原子均共平面 |
| D.有机物2能使酸性高锰酸钾溶液褪色,而1不能使酸性高锰酸钾溶液褪色 |