(16分)工业上利用(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵)、H2C2O4(草酸)、K2C2O4(草酸钾)、双氧水等为原料制备K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾晶体)的部分实验过程如下:
反应的原理如下:
沉淀:(NH4)2Fe(SO4)2·6H2O+H2C2O4 FeC2O4·2H2O↓+(NH4)2SO4+H2SO4+4H2O
FeC2O4·2H2O↓+(NH4)2SO4+H2SO4+4H2O
氧化:6FeC2O4+3H2O2+6K2C2O4 4K3[Fe(C2O4)3]+2Fe(OH)3
4K3[Fe(C2O4)3]+2Fe(OH)3
转化:2Fe(OH)3+3H2C2O4+3K2C2O4 2K3[Fe(C2O4)3]+6H2O
2K3[Fe(C2O4)3]+6H2O
(1)溶解的过程中要加入几滴稀硫酸,目的是 。
(2)沉淀过滤后,用蒸馏水洗涤,检验洗涤是否完全的方法是 。
(3)在沉淀中加入饱和K2C2O4溶液,并用40 ℃ 左右水浴加热,再向其中慢慢滴加足量的30%H2O2溶液,不断搅拌。此过程中温度不宜过高的原因可能是 。
(4)为测定该晶体中铁的含量,该工厂化验室做了如下实验:
步骤一:称量5.00 g三草酸合铁酸钾晶体,配制成250. 00mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀硫酸酸化,滴加KMnO4溶液至草酸根离子恰好全部氧化成二氧化碳。向反应后的溶液中加入足量锌粉,Fe3+被还原为Fe2+。然后过滤、洗涤,将滤液及洗涤液一并转入锥形瓶,此时溶液仍呈酸性。
步骤三:用标准KMnO4溶液滴定步骤二所得溶液中的Fe2+,记录消耗KMnO4溶液的体积(滴定中MnO4—被还原成Mn2+)。
步骤四: ……
步骤五:计算,得出结论。
请回答下列问题:
① 步骤一中需要用到的玻璃仪器有烧杯、量筒、玻璃棒、 、
② 步骤二中若加入KMnO4的量不足,则测得铁含量 (填“偏低”、“偏高”或“不变”);
③ 写出步骤三中发生反应的离子方程式:
④ 请补充步骤四的操作:
PTT是近几年来迅速发展起来的新型热塑性聚酯材料,具有优异性能,能作为工程塑料,纺织纤维和地毯等材料而得到广泛应用.其合成路线可设计为:
其中A,B,C均为链状化合物,A ,B均能发生银镜反应,C中不含甲基,1mol C可与足量钠反应生成22.4 L H2 (标准状况).
请回答下列问题:
(1)A中所含官能团的名称为,B的结构简式为.
(2)由物质C与D反应生成PTT的化学方程式为,反应类型为.
(3)分子式为C4H6O,与A互为同系物的同分异构体有种.
(4)请补充完整下列以CH2=CHCH3为主要原料(无机试剂任用)制备CH3CH(OH)COOH的合成路线流程图(须注明反应条件).
金属镍,铁及非金属元素碳在合金材料,有机合成材料中有广泛的应用.请回答下列问题:
(1)Ni原子的核外电子排布式为.
(2)Fe原子的外围电子排布图为.
(3)含碳化合物丙烯腈(H2C=CH—C≡N)分子中碳原子轨道杂化类型为
(4)NiO,FeO的晶体类型均与氯化钠晶体相同,Ni2+和Fe2+离子半径分别为69 Pm和78 Pm,则两种物质的熔点
NiOFeO(填“>”或“<”),判断依据是.
(5)CaC2晶体的晶胞也与氯化钠相似,但由于CaC2晶体中的C22-存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C22-周围距离最近且相等的Ca2+数目为,C22-与O22+互为等电子体,写出O22+的电子式.
(6)铁在一定条件下可形成体心立方堆积的晶体,设铁原子半径为r,请用含r的代数式表示该晶体空间利用率.
亚氯酸钠(NaC1O2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖,油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图: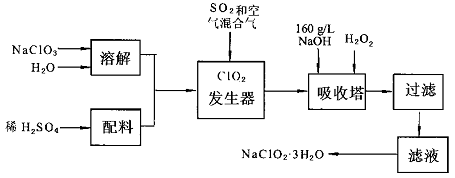
已知:①NaC1O2的溶解度随温度升高而增大,适当条件下可结晶析出NaC1O2·3H2O.
②纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.
I.请根据上述流程回答下列问题
(1)发生器中鼓入空气的作用可能是
(2)吸收塔内的反应的化学方程式为.吸收塔的温度不能超过20℃,其目的是.
(3)在碱性溶液中NaC1O2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是.
(4)从滤液中得到NaC1O2·3H2O粗晶体的实验操作依次是.
II.上述流程中的原料NaC1O3可由氯气通入热的烧碱溶液后重结晶就得到比较纯净的产品,所以通常工厂联合氯碱车间制备.
(1)氯碱工业中的原料为,原料需要净化的原因是,阳极产品为
(2)工业生产NaC1O3的化学方程式为
甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g)+2H2(g) CH3OH(g)ΔH1
CH3OH(g)ΔH1
反应II: CO2(g)+3H2(g) CH3OH(g)+ H2O(g)ΔH2
CH3OH(g)+ H2O(g)ΔH2
①上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”).
②在其他条件不变得情况下,考察温度对反应II的影响,实验结果如图所示
由图中数据判断ΔH20 (填“>”,“=”或“<”).
③某温度下,将2 mol CO2和6 mol H2充入2L的密闭容器中,发生反应II,达到平衡后,测得c(CO2)= 0.2 mol/L,则此时容器中的压强为原来的倍
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g)ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH =-44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为。
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池负极的电极反应为
②此电池消耗甲醇1.6克时,反应中电子转移数目为
③若以此燃料电池为铅蓄电池充电,则应将图中右侧电极连接蓄电池的(填正极或负极)
X,Y,Z,Q,R是五种短周期元素,原子序数依次增大.X,Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z,R分别是地壳中含量最高的非金属元素和金属元素.请回答下列问题:
(1)上述元素原子半径由大到小的顺序是(写元素符号)
(2)X,Y,Z能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写名称)
该物质能使酸性高锰酸钾溶液褪色同时生成一种生活中常见有机物,此过程的离子方程式为
(3)由以上某些元素组成的化合物A,B,C,D有如下转化关系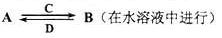
其中C是溶于水显酸性的气体;D是淡黄色固体.
写出C的结构式;
①如果A,B均由三种元素组成,B为两性不溶物,则由A转化为B的离子方程式
②如果A由三种元素组成,B由四种元素组成,A,B溶液均显碱性.用离子方程式表示A溶液显碱性的原因. A,B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有