M、N、R、T为周期表中前四周期相邻两个周期的元素,且原子序数依次增大。已知T的次外层上电子没有排满,且该能层中成对电子数等于其它各能层上电子的总数;R和T在同一族;N的外围电子总数为6,均为未成对电子。根据以上信息,回答下列问题:
(1)T的元素符号为 ,在周期表中位于 族,N的价电子排布式为 。
(2)M和R两种元素组成的常见化合物有两种,其中一种可以单质之间进行化合,生成R的高价态化合物,请写出该反应的化学方程式: 。
(3)表面上附着氮原子的R可做为工业催化剂,下图为氮原子在R的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表R原子)。则图示颗粒表面上氮原子与R原子的个数比为 。
(4)T、N都有多种配合物,[T(NH3)3(H2O)M2]M是T配合物的一种,其中心离子的化合价为 ,配位数为 。N与甲基丙烯酸根的配合物为: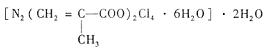 该化合物中存在的化学键类型有 。甲基丙烯酸分子中C原子的杂化方式有 。
该化合物中存在的化学键类型有 。甲基丙烯酸分子中C原子的杂化方式有 。
某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意图如下:
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后生成Ca(OH)2,进而发生若干个复分解反应,试写出其中任意一个反应的离子方程式
_____________________________________________________________。
(2)加入凝聚剂可以除去其中的悬浮固体颗粒,该过程是________(填写下列各项的序号)
①只有物理过程,无化学过程
②只有化学过程,无物理过程
③既有化学过程又有物理过程
FeSO4·7H2O是常用的凝聚剂,加入后最终生成红褐色胶状沉淀,则这种沉淀是________。
(3)通入二氧化碳的目的是________和________。
(4)气体A的作用是______________________________________________________。
(5)下列物质中,________(填写下列各项的序号)可以作为气体A的代替品。
①ClO2 ②浓氨水 ③SO2 ④浓硫酸
在一条鱼虾几乎绝迹的小河边从上游到下游依次有四座工厂,甲、乙、丙、丁四厂排放的废液中含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种;某中学环保小组对河水检测时发现:甲处河水呈乳白色,乙处河水呈红褐色,丙处河水变浑浊,丁处产生气泡,河水仍然澄清。试回答:
(1)四处河水排放的污染物分别是:甲________,乙________,丙________,丁________。
(2)在丁处的下游取出的河水中,肯定含有的离子是_____________________________。
(3)小河中鱼虾绝迹的原因是_______________________________________________。
某城市用水中含c(Ca2+)为1.0×10-3 mol·L-1,c(Mg2+)为5.0×10-4 mol·L-1,c(HCO3-)为8.0×10-4 mol·L-1。如用药剂软化该水1 000 L,应加入Ca(OH)2________g,Na2CO3________g;如果水中含Mg2+,加入Na2CO3后,为尽量减少水中的Mg2+的浓度,可将水加热至沸,加热时反应的化学方程式为________。
海水资源的利用具有非常广阔的前景。
(1)海水淡化的主要方法有(只写出1种即可)________。
(2)海水中丰富的氯化钠是重要的化工原料,如电解饱和食盐水可以制备多种化工产品。
①用石墨电极电解饱和食盐水时,阴极的电极反应式是
_______________________________________________________________。
②常温下,用石墨电极电解饱和食盐水,当阴极产生的气体体积为112 mL(已折算为标准状况)时停止电解,此时溶液体积为1 L,若忽略气体的溶解,最终溶液的pH约为________。
地球的海水总量约有1.4×1018 t,是人类最大的资源库
(1)如图利用海水得到淡水的方法为________。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图: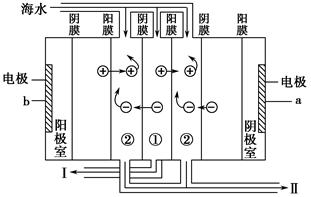
a是电源的________极;I口排出的是________(填“淡水”或“浓水”)。
(3)海水淡化后的浓水中含大量盐分,排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产。
①电解前需要把浓水精制,加入试剂的顺序为___________________________________;
②用离子交换膜电解槽电解食盐水的化学方程式为
_________________________________________________________________________________________________________________________________。
(4)铀是核反应最重要的燃料,其提炼技术直接关系着一个国家核工业或核武器的发展水平,海水中铀以UCl4形式存在,每吨海水只含3.3 mg铀,海水总量极大,铀总量相当巨大。不少国家正在探索海水提铀的方法。现在,已经研制成功了一种螯合型离子交换树脂,它专门吸附海水中的铀,而不吸附其他元素。其反应原理为________(树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为_______________________________________________________________________________________________________________________________。