甲醇是一种很好的燃料,工业上可用多种原料通过不同的反应制得甲醇.
(1)已知在常温常压下:
CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=﹣442.8kJ•mol﹣1
2CO(g)+O2(g)=2CO2(g)△H=﹣566.0kJ•mol﹣1
H2O(g)=H2O(l)△H=﹣44.0kJ•mol﹣1
则2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=
(2)已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1
H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为____________________
(3)工业上正在研究利用来生产甲醇燃料的方法,该反应为:
CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g)△H=﹣49.0kJ•mol﹣1
在某温度下,将6mol CO2和8mol H2充入容积为2L的密闭容器中,8分钟时达平衡状态,H2的转化率为75%.请回答:
①用CH3OH表示该反应在0﹣8min内的平均反应速率v(CH3OH)= .
②此温度下该反应平衡常数K= ;
(4)一氧化碳与氢气也可以合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H<0
①若该反应在恒温恒容条件下进行,下列说法正确的是 ;
a.若混合气体的密度不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入CH3OH(g)使压强增大,平衡向右移动
c.反应达到平衡后,通入氩气使压强增大,平衡向右移动
d.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
e.若使用催化剂,会改变反应的途径,但反应热不变
②某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数K=50L2•mol﹣2,反应到某时刻测得各组分的物质的量如下:
| 物质 |
CO |
H2 |
CH3OH |
| 物质的量/(mol) |
0.4 |
0.4 |
0.8 |
请比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”).
X、Y、Z、W四种常见元素,且均为短周期元素。已知:①X的最高价氧化物对应的水化物为无机酸中最强酸;②Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料;③Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料;④W被称为军事金属,可在CO2中燃烧。
(1)X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为。
(2)Z的氧化物在通信领域用来作,工业上制Z单质的化学反应方程式为。
(3)在50mL lmol·L-1的YX3溶液中逐滴加入0.5mol·L-1的NaOH溶液,得到1.56g沉淀,则加入NaOH溶液的体积最多为mL。
(4)Y、W合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某Y、W合金(设不含其他元素)中W的质量分数,设计下列实验方案进行探究。称量x g Y、W合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。
欲计算W的质量分数。该实验中还需测定的数据是。若用空气代替O2进行实验,对测定结果是否有影响?若有影响分析其原因。
二氧化锰是化学工业中常用的氧化剂和有机合成中的催化剂,其主要制备方法是碳酸锰热分解,反应原理为2MnCO3+O2 2MnO2+2CO2。经研究发现该反应过程为①MnCO3
2MnO2+2CO2。经研究发现该反应过程为①MnCO3 MnO+CO2②2MnO+O2
MnO+CO2②2MnO+O2 2MnO2。
2MnO2。
回答下列问题:
(1)某温度下该平衡体系的压强为P,CO2、O2的物质的量分别为n1和n2,用平衡分压代替平衡浓度,写出碳酸锰热分解反应的平衡常数表达式K=(分压=总压×物质的量分数);K与反应①、②的平衡常数K1、K2关系为。
(2)反应②在低温下能自发进行,则其△H0(填“>”、“<”、“=”)。
(3)某科研小组对碳酸锰热分解法制二氧化锰的条件(焙烧温度和气氛)进行了研究,获得如下三幅图。该制备反应合适的焙烧温度为,合适的含水量气氛条件为。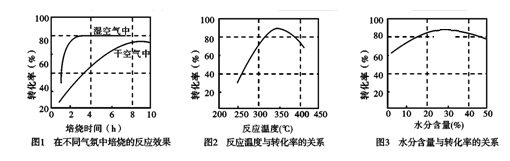
(4)MnO2也可在MnSO4—H2SO4—H2O为体系的电解液中电解获得,其阳极的电极反应式为,电解后溶液的pH将(填“增大”、“ 减小”或“不变”)。
已知某溶液中可能含有NO3-、Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液的成分,某学习小组做了如下实验:
①取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;
②将沉淀过滤、洗涤、灼烧,得到1.6 g固体;
③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。
请回答下列问题:
(1)结合①和②,判断原溶液中肯定含有的离子是,可以排除的离子是。
(2)由③推知原溶液中一定有离子,其物质的量为mol。
(3)综合(1)、(2)及题干信息,结合溶液中电荷守恒知识,还可以排除的离子是。该学习小组最终得出结论:该溶液由种阳离子(填数字,下同)和种阴离子组成。
金属铅为带蓝色的银白色重金属,其单质及化合物可用于铅蓄电池、耐酸设备及X射线防护材料。回答下列问题:
(1)铅蓄电池是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O。写出放电时负极的电极反应式。
2PbSO4+2H2O。写出放电时负极的电极反应式。
(2)早在古代,硫酸铅就被用作白色颜料,但用这种颜料作出的画天长日久会变为黑色,经检测其成分为PbS。古画修复师在变黑处涂抹H2O2后即可将颜色修复,用化学方程式表示古画修复颜色的原理。
(3)PbO与次氯酸钠溶液反应可以制得PbO2,写出该反应的离子方程式。
(4)PbO2在加热过程中发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%( )的残留固体,若a点固体表示为PbOx或mPbO2·nPbO,列式计算x=,m:n=。
)的残留固体,若a点固体表示为PbOx或mPbO2·nPbO,列式计算x=,m:n=。
结晶玫瑰是一种具有玫瑰香气的香料,可由下列方法合成(部分反应物及反应条件未标出):
请回答下列问题:
(1)已知A是苯的一种同系物,写出A的结构简式。
(2)C的同分异构体中,属于芳香族化合物的还有种。
(3)①的反应类型是。
(4)写出②的化学方程式。