(12 分)CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol·L-1的CH3COOH溶液与50mL 0.2mol·L-1的NaOH溶液混合,所得溶液呈 性,原因 (用离子方程式表示)。
(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)> c(H+)> c(Na+)> c(OH-),则该溶液中含有的溶质为 。
(4)已知Ka(CH3COOH)= 1.76×10-5,Ka(HNO2)= 4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:
前者 后者(填“>,<或=”)
(5)已知25℃时,0.1mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠呈碱性,所以溶液的pH增大;乙同学给出另外一种不同于甲同学的解释,请你写出乙同学可能的理由
氨气与氟气在铜的催化作用下反应得到一种铵盐NH4F和一种含氮化合物A,A的分子结构呈三角锥形,分子中所有共价键之间的夹角都相等。
(1)A的化学式为 ,A的电子式为 。
(2)写出该反应的化学方程式 。
(3)现有1 mol混合气体充分反应后,测得生成物NH4F中的N元素比A中的N元素多2.8 g,试计算原混合气中NH3和F2的物质的量可能各是多少?
等物质的量A、B、C、D四种物质混合,发生如下反应:
aA(?)+bB(?) cC(固)+dD(?)
cC(固)+dD(?)
当反应进行到一定时间后,测得A减少n mol,B减少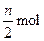 ,C增加
,C增加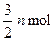 ,
,
D增加n mol,此时达到化学平衡状态.
(1)该化学方程式中各系数为a=________,b=________,c=________,d=________.
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,则该反应中各物质的聚集状态是:A_________,B_________,D_________.
(3)若只升高温度,反应一段时间后,测知四种物质的量又达到相等,则该反应是________反应(填“放热”或“吸热”
今有a盐酸、b硫酸、c醋酸三种酸:
(1)在同体积、同pH的三种酸中分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是。(填酸的序号,下同)
(2)在同体积、同浓度的三种酸中,分别加入足量的碳酸钠粉末在相同条件下产生CO2的体积由大到小的顺序是。
(3)物质的量浓度均为0.1mol/L的三种酸溶液,pH由大到小的顺序是
下图表示在密闭容器中反应:
2SO2+O2 2SO3△H<0,达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是;b~c过程中改变的条件可能是;若增大压强时,反应速度变化情况画在c~d处.
2SO3△H<0,达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是;b~c过程中改变的条件可能是;若增大压强时,反应速度变化情况画在c~d处.
(26分)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
| ① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 探究温度对该反应速率的影响; (Ⅲ)实验①和 探究大理石规格(粗、细)对该反应速率的影响。 |
| ② |
||||
| ③ |
||||
| ④ |
(2)实验①中CO2质量随时间变化的关系见下图:
请在图中画出实验②和④中CO2质量随时间变化关系的预期结果示意图。