氮、硫、碳的氧化物都会引起环境问题,越来越引起人们的重视。
(1)下列关于氮、硫、碳氧化物的叙述中,正确的是__________:
①氮的氧化物是形成酸雨的重要原因之一
②SO2具有漂白作用,可用来熏制鲜姜、辣椒,起到保鲜、增亮的作用
③NO在扩张血管、免疫、增强记忆等方面有重要作用
④NO2、CO都能跟血红蛋白结合而引起人体缺氧中毒
⑤氮氧化物与碳氢化合物经紫外线照射发生反应形成光化学烟雾。
(2)在汽车的排气管上安装“催化转化器”(用铂、钯合金作催化剂),可以使CO、NO反应生成可参与大气生态环境循环的无毒气体,写出CO与NO反应的化学方程式 。工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学反应方程式 。
(3)你认为减少酸雨产生的途径可采用的措施是_____ ___(填代号)。
①少用煤作燃料
②把工厂烟囱造高
③燃料脱硫
④在已酸化的土壤中加石灰
⑤开发新能源
| A.①②③ | B.②③④⑤ | C.①③⑤ | D.①③④⑤ |
(4)硫酸厂可用足量的烧碱来吸收SO2,其化学反应方程式为 。
(16分)“司乐平”是治疗高血压的一种临床药物,其有效成分M的结构简式如右图所示。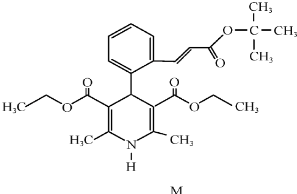
(1)下列关于M的说法正确的是______(填序号)。
a.属于芳香族化合物b.遇FeCl3溶液显紫色
c.能使酸性高锰酸钾溶液褪色 d.1molM完全水解生成2mol醇
(2)肉桂酸是合成M的中间体,其一种合成路线如下: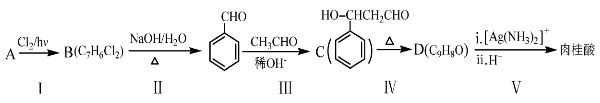
已知: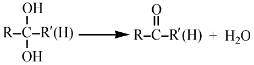
①烃A的名称为______。步骤I中B的产率往往偏低,其原因是__________。
②步骤II反应的化学方程式为______________。
③步骤III的反应类型是________.
④肉桂酸的结构简式为__________________。
⑤C的同分异构体有多种,其中苯环上有一个甲基的酯类化合物有_____种。
某废水中可能含有下列离子中的若干种:
Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-。现进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅳ.向Ⅱ中所得的溶液中加入过量浓氨水,仅有红褐色沉淀生成。过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成。
请回答下列问题:
(1)该废水一定含有的离子是________。
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是___________。
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1: 4,其离子方程式为Al+NO3-+OH-―→AlO2-+NH3+N2+H2O(未配平)。还原产物是________。若除去0.2 mol NO3-,要消耗铝________g。
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理。下列处理措施和方法中正确的是________。
| 选项 |
污染物 |
处理措施 |
方法类别 |
| A |
碱性的废水 |
用CO2中和 |
化学法 |
| B |
Cu2+等重金属离子 |
加硫酸盐沉降 |
化学法 |
| C |
含复杂有机物的废水 |
通过微生物代谢 |
物理法 |
| D |
废酸 |
加生石灰中和 |
化学法 |
高锰酸钾(KMnO4)和过氧化氢(H2O2)是两种典型的氧化剂。
Ⅰ、(1)H2O2的结构式为______________。
(2)下列物质中能使酸性KMnO4溶液褪色的是________(填选项字母)。
| A.臭碱(Na2S) | B.小苏打(NaHCO3) |
| C.水玻璃(Na2SiO3) | D.酒精(C2H5OH) |
(3)高锰酸钾、双氧水、活性炭常用于饮用水的处理,但三者联合作用时必须有先后顺序。
在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e-→2H++O2↑
还原反应:MnO4-+5e-+8H+→Mn2++4H2O
写出该氧化还原反应的离子方程式________________
Ⅱ、在处理饮用水时,活性炭应在高锰酸钾反应结束后投加。
(1)请将下列五种物质:KBr、Br2、I2、KI、K2SO4分别填入下列横线上,组成一个未配平的化学方程式:
KBrO3+________+H2SO4―→________+________+________+________+H2O。
(2)如果该化学方程式中I2和KBr的化学计量数分别是8和1,则:
①Br2的化学计量数是________;
②请将反应物的化学式及配平后的化学计量数填入下列相应的位置中:
③若转移10 mol e-,则反应后生成I2的物质的量为________。
〔化学——选修3:物质结构与性质〕举世瞩目的中国探月工程三期再入返回试验器于2014年10月24日凌晨成功发射,为实现月球采样和首次地月往返踏出了成功的第一步。探月工程三期的主要目标是实现无人自动采样返回,突破月面采样、月面上升、月球轨道交会对接等核心关键技术。已知所用火箭推进剂为肼(N2H4)和过氧化氢(H2O2),火箭箭体一般采用钛合金材料。
请回答下列问题:
(1)N2H4、H2O2分子中电负性最大的元素在周期表中的位置为 ,第一电离能最大的元素为 。
(2)钛的原子序数为22,其基态电子排布式示意图为 。
(3)1 mol N2H4分子中含有的键数目为 。
(4)H2O2分子结构如图1,其中心原子杂化轨道为 ,估计它难溶于CS2,简要说明原因 。
(5)氮化硼其晶胞如图2所示,则处于晶胞顶点上的原子的配位数为 ,若立方氮化硼的密度为g·cm-3,阿伏加德罗常数为NA,则两个最近N原子间的距离为________cm。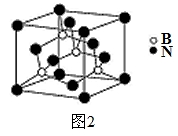
煤化工中两个重要反应为①C(s)+H2O(g) H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,②CO(g)+ H2O(g)
H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,②CO(g)+ H2O(g) CO2(g) + H2(g)。
CO2(g) + H2(g)。
(1)下列说法正确的是 。
| A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度 |
| B.反应②的熵变△S >0 |
| C.反应①中增加C固体的量能增大反应速率 |
| D.在反应中②及时分离出产生的H2对正反应速率无影响 |
(2)若工业上要增加反应①的速率,最经济的措施为 。
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如下三组数据:
| 实验组] |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/ min |
||
| CO |
H2O |
H2 |
CO2 |
|||
| I |
650 |
4 |
2 |
1.6 |
1.6 |
5 |
| Ⅱ |
900 |
2 |
1 |
0.5 |
0.5 |
3 |
| Ⅲ |
900 |
a |
b |
c |
d |
t |
①实验I中,从反应开始到反应达到平衡时,H2O的平均反应速率为___。
②CO(g)和H2O(g)反应的△H 0(填“大于”、“小于”或“等于”)
③实验III中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是_____,与实验Ⅱ相比,化学平衡常数 (填“增大”、“减小”或“不变”)。
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1 mol CO、0.5 mol H2O、0.2 mol CO2、0.5 mol H2,平衡向________方向移动(填“正反应”、“逆反应”“不移动”)。
(4)CO、H2可用于甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g) CH3OH(g) ΔH= -mkJ·mol-1
CH3OH(g) ΔH= -mkJ·mol-1
反应②: 2CO(g)+4 H2(g) CH3OCH3(g) +H2O(g) ΔH=-nkJ·mol-1
CH3OCH3(g) +H2O(g) ΔH=-nkJ·mol-1
反应③:2CH3OH(g) CH3OCH3(g)+ H2O(g) △H<0
CH3OCH3(g)+ H2O(g) △H<0
则m与n的关系为 。