小刚同学探究二氧化硫分别与BaCl2溶液、Ba(OH)2溶液反应的实验。
(1)少量SO2通入到Ba(OH)2溶液中的离子反应方程式为 ,过量的SO2通入到Ba(OH)2溶液中的离子反应方程式为 。
(2)请回答有关问题。小刚同学将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:
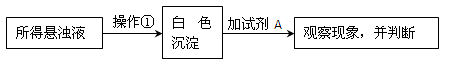
则操作①的名称为 ,试剂A的化学式为 。
(3)实验表明,小刚加入试剂A后,白色沉淀未见溶解,则该白色沉淀的成分是______(填化学式),则产生该白色沉淀的离子方程式是__ _ ___。
用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)制取高纯铁红,实验室常用萃取剂X(甲基异丁基甲酮)萃取法制取高纯铁红的主要实验步骤如下: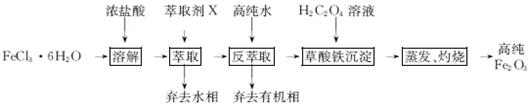
已知:HCl(浓)+FeCl3 HFeCl4
HFeCl4
试回答下列问题:
(1)用萃取剂X萃取,该步骤中:
①Ca、Mn、Cu等杂质离子几乎都在(填“水”或“有机”)相。
②若实验时共用萃取剂X 120 mL,萃取率最高的方法是(填字母)。
a.一次性萃取,120 mL
b.分2次萃取,每次60 mL
c.分3次萃取,每次40 mL
(2)用高纯水反萃取,萃取后水相中铁的存在形式是(写化学式);反萃取能发生的原因是。
(3)所得草酸铁沉淀需用冰水洗涤,其目的是。
(4)测定产品中铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标准K2Cr2O7溶液滴定,已知铬的还原产物为Cr3+,写出该滴定反应的离子方程式,并用单线桥标出电子转移的方向和数目。
(本题共14分)肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料。实验室用下列反应制取肉桂酸。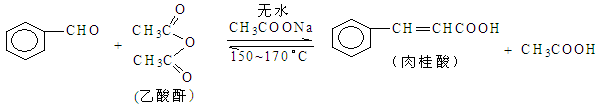
药品物理常数
| 苯甲醛 |
乙酸酐 |
肉桂酸 |
乙酸 |
|
| 溶解度(25℃,g/100g水) |
0.3 |
遇热水水解 |
0.04 |
互溶 |
| 沸点(℃) |
179.6 |
138.6 |
300 |
118 |
| 相对分子质量 |
106 |
102 |
148 |
60 |
填空:
Ⅰ.合成:反应装置如图所示。向三颈烧瓶中先后加入研细的无水醋酸钠、4.8g苯甲醛和5.6g乙酸酐,振荡使之混合均匀。在150~170℃加热1小时,保持微沸状态。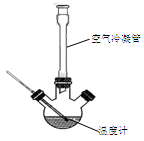
(1)空气冷凝管的作用是_______________________________________。
(2)该装置的加热方法是_____________________________。加热回流要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是______________________________________。
(3)不能用醋酸钠晶体(CH3COONa·3H2O)的原因是____________________________________。
Ⅱ.粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作: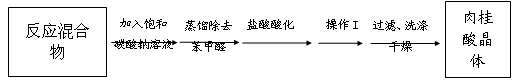
(4)加饱和Na2CO3溶液除了转化醋酸,主要目的是__________________________________。
(5)操作I是_________________________________;
(6)设计实验方案检验产品中是否含有苯甲醛_______________________________________。
(7)若最后得到纯净的肉桂酸5.0g,则该反应中的产率是____________(保留两位有效数字)。
铝硅合金材料性能优良。铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)干法制取该铝硅合金的工艺如下: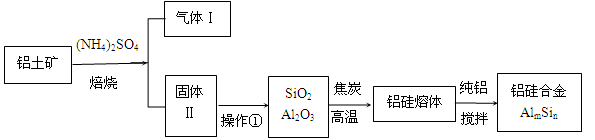
(1)焙烧除铁反应:
4(NH4)2SO4 + Fe2O3  2NH4Fe(SO4)2 + 3H2O + 6NH3↑
2NH4Fe(SO4)2 + 3H2O + 6NH3↑
(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为。指出气体Ⅰ的用途(任写一种)。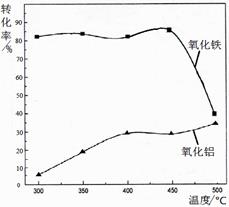
(2)操作①包括:加水溶解、。若所得溶液中加入过量NaOH溶液,含铝微粒发生反应的离子方程式为。
(3)用焦炭还原SiO2、Al2O3会产生中间体SiC、Al4C3。任写一个高温下中间体又与Al2O3反应生成铝、硅单质的化学方程式。
(4)若湿法处理铝土矿,用强酸浸取时,所得溶液中阳离子有,假设该溶液中Al3+物质的量浓度为1.0 × 10-3mol/L,如果要将溶液在中的金属阳离子分离,则应控制溶液pH的范围为(计算结果保留2位有效数字)。
(已知:Ksp[Fe(OH)3] =" 8.0" × 10-38,Ksp[Al(OH)3] =" 1.0" × 10-33,lg5 = 0.7)
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示: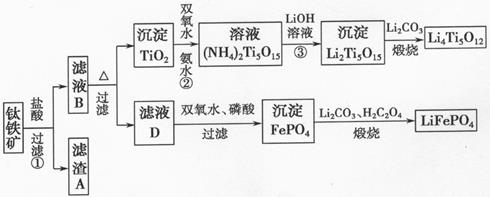
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl—= Fe2++ TiOCl42—+2H2O
(1)化合物FeTiO3中铁元素的化合价是_______。
(2)滤渣A的成分是_______。
(3)滤液B中TiOCl42-和水反应转化生成TiO2的离子方程式是_______。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15 溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti元素浸出率下降的原因_。
(5)反应③的化学方程式是。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是_______。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:
Li4Ti5O12 + 3LiFePO4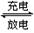 Li7Ti5O12 + 3FePO4 该电池充电时阳极反应式是:。
Li7Ti5O12 + 3FePO4 该电池充电时阳极反应式是:。
某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4·5H2O)、无水AlCl3和铁红的过程如下图所示: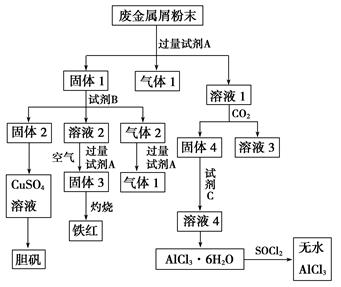
请回答:
(1)在废金属屑粉末中加入试剂A,生成气体1的反应的离子方程式是________________________。
(2)溶液2中含有的金属阳离子是__________;气体2的成分是__________。
(3)溶液2转化为固体3的反应的离子方程式是__________________________________。
(4)利用固体2制取CuSO4溶液有多种方法。
①在固体2中加入浓H2SO4并加热,使固体2全部溶解得CuSO4溶液,反应的化学方程式是___________________________________________________________________。
②在固体2中加入稀H2SO4后,通入O2并加热,使固体2全部溶解得CuSO4溶液,反应的离子方程式是_________________________________________________________。
(5)溶液1转化为溶液4过程中,不在溶液1中直接加入试剂C,理由是_________________________
(6)直接加热AlCl3·6H2O不能得到无水AlCl3。SOCl2为无色液体,极易与水反应生成HCl和一种具有漂白性的气体。AlCl3·6H2O与SOCl2混合加热制取无水AlCl3,反应的化学方程式是_________________。