中和滴定实验⑴取体积相同(25mL)的两份 溶液,将其中一份放在空气中一段时间后,溶液的pH (填“增大”“减小”或“不变”)其原因是 。用已知浓度的盐酸中和上述两份溶液。若中和放在空气中一段时间后的那份溶液消耗盐酸的体积为
溶液,将其中一份放在空气中一段时间后,溶液的pH (填“增大”“减小”或“不变”)其原因是 。用已知浓度的盐酸中和上述两份溶液。若中和放在空气中一段时间后的那份溶液消耗盐酸的体积为 ,中和另一份溶液消耗盐酸的体积为
,中和另一份溶液消耗盐酸的体积为 ,则(1)以甲基橙为指示剂
,则(1)以甲基橙为指示剂 和
和 的关系是 。(2)以酚酞为指示剂时,
的关系是 。(2)以酚酞为指示剂时, 和
和 的关系是 。
的关系是 。
⑵某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作( )
| A.在250mL的容量瓶中定容配成250mL烧碱溶液 |
| B.用移液管移取25mL烧碱溶液于锥形瓶中并滴几滴指示剂甲基橙 |
| C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解 |
| D.将物质的量浓度为C的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1 |
E. 在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:(1)正确操作步骤的顺序是(用字母填写) → → → D → 。
(2)滴定管的读数应注意 。
(3)E中在锥形瓶下垫一张白纸的作用是 。(4)D步骤中液面应调节到 ,尖嘴部分应 。
(5)滴定终点时锥形瓶内溶液的pH约为 ,终点时颜色变化是 。
(6)若酸式滴定管不用标准硫酸润洗,在其它操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?(指偏高、低或不变) (7)该烧碱样品纯度的计算式为 。
图2是研究甲烷取代反应实验装置图,具体的实验方法是:
取一个100 mL的大量筒,先后收集20 mL CH4和80 mL Cl2,进行实验。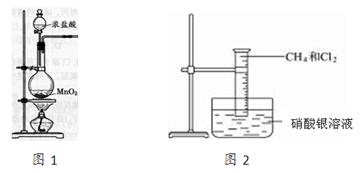
(1)实验室制取氯气的装置如上图1所示,请写出烧瓶中的反应方程式为:
。浓盐酸在反应中体现了
性和性。
(2)下列常用的干燥剂中,不能干燥氯气的是。
| A.浓硫酸 | B.P2O5 | C.无水氯化钙 | D.碱石灰 |
(3)氯气是色的有毒气体,实验中剩余的氯气可用NaOH溶液吸收,请写出发生的离子方程式:。
(4)若研究甲烷与氯气的取代反应,还需要的条件是___________。若将如图2所示装置放在强光下照射会有_________________(填可能发生的不良后果)。
(5)若量筒中的甲烷和氯气的量比较大,放在光亮的地方足够长的时间,下方水槽中的现象是_________________________________,产生此现象的原因是:__________________________(用简要的文字和方程式说明)。
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验。请填写下列空白:
[实验一]用如图所示装置,排水法收集一试管甲烷和氯气的混合气体,光照后观察到量筒内形成一段水柱,认为有氯化氢生成。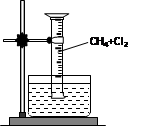
(1)该反应的化学方程式为;(只写第二步)
(2)水槽中盛放的液体最好为;(填标号)
| A.水 | B.饱和石灰水 | C.饱和食盐水 | D.饱和NaHCO3溶液 |
[实验二]用排蒸馏水法收集一试管甲烷和氯气的混合气体,光照反应后,
滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成。
(3)该实验设计的错误之处;
[实验三]
步骤一:收集半试管氯气,加入10 mL 蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同)。测得pH = 3.26。
步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在40 W的日光灯下光照6 min后,加入10 mL 蒸馏水,充分振荡,测得pH = 1.00。
(4)判断该反应中有氯化氢生成的依据是;
(5)假设氯气完全参与反应,且不考虑氯气溶解于水。往反应后的溶液中加水稀释到100.00 mL,取20.00 mL稀释液,加入10.00 mL浓度为0.01 mol·L-1的AgNO3溶液恰好完全反应,则试管中原有氯气在标准状况下的体积为mL;
某研究小组对铁生锈进行研究: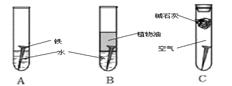
(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是(填字母);
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为:;
(3)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是
A. 锡 B. 铜 C. 锌
(4)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下: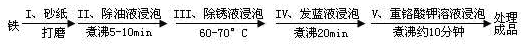
为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
控制变量法是研究化学变化量的重要思想方法。请仔细观察下表中50mL
稀盐酸和1g碳酸钙反应的实验数据:
| 实验 序号 |
碳酸钙 状态 |
C(HCl)/ mol·l-1 |
溶液温度/℃ |
碳酸钙消失 时间/s |
|
| 反应前 |
反应后 |
||||
| 1 |
块状 |
0.5 |
20 |
39 |
400 |
| 2 |
粉末 |
0.5 |
20 |
40 |
60 |
| 3 |
块状 |
0.6 |
20 |
41 |
280 |
| 4 |
粉末 |
0.8 |
20 |
40 |
30 |
| 5 |
块状 |
1.0 |
20 |
40 |
120 |
| 6 |
块状 |
1.0 |
30 |
50 |
40 |
(1)该反应属于反应(填“吸热”或“放热”)。
(2)实验5、6表明对反应速率的影响。
(3)从本实验数据中分析,影响化学反应速率的因素还有,能表明这
一规律的实验序号是。
(6分,每空格2分)维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在其弱酸性溶液中用I2溶液进行滴定。
该反应的化学方程式为:C6H8O6+I2=C6H6O6+2HI
现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下:
①取10mL6mol·L-1CH3COOH,加入100mL蒸馏水,将溶液加热煮沸后放置冷却。
②准确称取0.2000g样品,溶解于上述冷却的溶液中,并加入1mL淀粉指示剂。
③随后,立即用浓度为0.0500 mol·L-1的I2溶液进行滴定,直至溶液中的蓝色持续不褪为止,共消耗21.00mLI2溶液。
(1)为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
①煮沸的原因
②冷却后才能使用的原因
(2)经过计算,样品中维生素C的百分含量为