下列实验事实能用平衡移动原理解释的是( )
A. |
B. |
C. |
D. |
下列叙述错误的是
| A.煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
| B.淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| C.乙烯和苯都能使溴水褪色,褪色的原因相同 |
| D.乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
NM-3和D-58是正处于临床试验阶段的小分子抗癌药物,结构如下: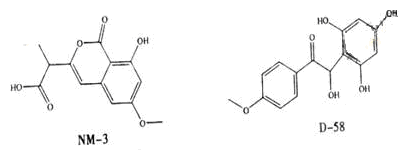
关于NM-3和D-58的叙述,错误的是
| A.都能与NaOH溶液反应,原因不完全相同 |
| B.都不能发生消去反应,原因相同 |
| C.都能与溴水反应,原因不完全相同 |
| D.遇FeCl3溶液都显色,原因相同 |
心酮胺是治疗冠心病的药物。它具有如下结构简式:
下列关于心酮胺的描述,错误的是()
| A.可以在催化剂作用下和溴反应 | B.可以和银氨溶液发生银镜反应 |
| C.可以和氢溴酸反应 | D.可以和浓硫酸与浓硝酸的混合液反应 |
下列关于有机物的正确说法是
| A.聚乙烯可发生加成反应 |
| B.石油干馏可得到汽油、煤油等 |
| C.乙酸乙酯、油脂与NaOH溶液反应均有醇生成。 |
| D.淀粉、蛋白质完全水解的产物互为同分异构体 |
.下列说法正确的是
A.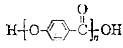 的结构中含有酯基 的结构中含有酯基 |
| B.顺-2-丁烯和反-2-丁烯的加氢产物不同 |
C.1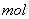 葡萄糖可水解生成2 葡萄糖可水解生成2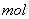 乳酸( 乳酸(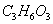 ) ) |
| D.油脂和蛋白质都是能发生水解反应的高分子化合物 |