现行中学教材中,有以下化学实验:
A.溴乙烷的水解
B.浓硫酸跟乙醇反应制乙烯
C.乙醛还原新制的氢氧化铜
D.乙酸乙酯的制取
E.石油的蒸馏
F.葡萄糖的银镜反应
G.乙酸乙酯的水解。
对以上实验,按下列各操作的要求,用字母A、B、C、——完成以下填空:(多填扣分)
(1)需用水浴加热的是 ;
(2)实验装置不需要检查气密性的是 ;
(3)为防止液体暴沸,常需加少量碎瓷片的是 ;
(4)需用温度计的是 。
用惰性电极电解200mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。
(1)电解过程中,a电极表面的现象是___________________________________;
(2)a电极上发生的反应为________________________________________________;
(3)从P点到Q点时收集到的混合气体的平均摩尔质量为___________ g·mol-1;
(4)如果要使溶液恢复到电解前的状态,向溶液中加入0.8 g CuO即可,则电解后溶液的pH为______;
(5)如果向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和pH(不考虑CO2的溶解),电解过程中转移的电子为______mol。
根据信息作答:
(1)在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。
①写出上述制备小苏打的化学方程式:__________________________________。
②滤出小苏打后,母液提取氯化铵有两种方法:Ⅰ.通入氨,冷却、加食盐,过滤;Ⅱ.不通氨,冷却、加食盐,过滤。其中方法Ⅰ析出的氯化铵的纯度更高,其原因是___________。而方法Ⅱ的优点是其滤液可以_______________。
(2)铅及其化合物可用于蓄电池,耐酸设备及X射线防护材料等。PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为_____________________:PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式_________________,电解液中加入Cu(NO3)2的原因是___________________。
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等氧化物杂质)制取金属锌的流程如图所示。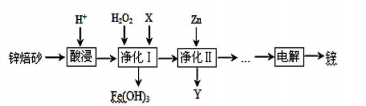
(1)提高酸浸效率的措施为____________(任答一条即可);酸浸时H+与难溶固体ZnFe2O4反应的离子方程式为____________________________。
(2)净化I中H2O2参与反应的离子方程式为_____________________;X可选择的试剂为___________(写化学式),净化II中Y为__________(写化学式);
(3)电解法制备锌的装置如图甲所示: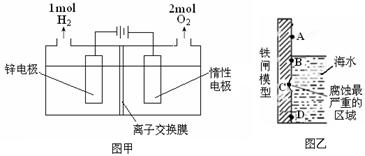
则电解槽中盛有的电解质溶液为__________(填字母);
a.ZnCl2溶液 b.Zn(NO3)2溶液 c.ZnSO4溶液
(4)使用含有[Zn(OH)4]2-的强碱性电镀液进行镀锌防腐蚀,可得到细致的光滑镀层,电镀时阴极电极反应式_______________。以锌为负极,采用牺牲阳极法防止铁闸的腐蚀,图乙中锌块的固定位置最好应在_________处(填字母)。
I.有机物A是构成营养素的基础物质,A的球棍模型如图所示,图中“棍” 代表单键或双键或三键,不同颜色的球代表不同元素的原子。回答下列问题: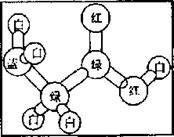
(1)A的分子式是。官能团的名称是 。
(2)下列有关于A的说法中,正确的是 (选填字母);
A.具有两性
B.能发生消去反应
C.不能发生酯化反应
D.名称为甘氨酸
II. A、B、C三种物质的分子式都是C7H8O,若滴入FeCl3溶液,
只有C呈紫色,且C苯环上的一溴代物有两种结构。若投入金
属钠,只有B没有变化。写出A、B、C的结构简式:A__________,B__________,C__________。
III.有机物X (C9H804)是一种应用最早、最广的药物之一,也是重要的合成中间体。有机物X的仪器分析如下: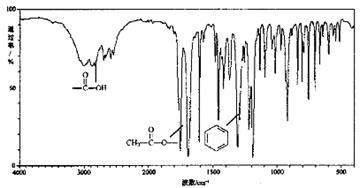
①有机物X的红外光谱
有机物X的核磁共振氢谱图峰面积比是1:1:1:1:3,已知X分子中苯环上只有两个相邻的取代基,则X的结构简式是 。
一份无色溶液中可能含有Na+、Fe3+、H+、Mg2+、CO32﹣、OH﹣、HCO3﹣、Cl﹣、SO42﹣等离子中的若干种。为了确定溶液的组成,进行了如下操作:
①向溶液中滴加酚酞试液,溶液显红色;
②取2mL溶液,先加足量稀硝酸酸化,有气体产生,再加氯化钡溶液进行检验,没有明显现象;
(1)原溶液中一定存在的离子是 ,一定不存在的离是 。
(2)经过上述操作后,还不能肯定是否存在的离子是 。对可能含有的离子,如何进行实验以进一步 。
(3)标准状况下,CO和CO2的混合气体的质量是9.6g,体积是6.72L,则CO2在混合物中的质量分数约为多少?