某有机物的结构简式如图所示,下列有关说法中不正确的是( )
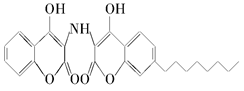
| A.分子式为C26H28O6N |
| B.遇FeCl3溶液不能发生显色反应 |
| C.1 mol该物质最多能与8 mol氢气发生加成反应 |
| D.1 mol该物质最多能与4 mol NaOH溶液完全反应 |
下列叙述中不正确的是()
| A.某特定反应的平衡常数仅是温度的函数 |
| B.催化剂不能改变平衡常数的大小 |
| C.化学平衡发生新的移动,平衡常数必发生变化 |
| D.平衡常数发生变化,化学平衡必定发生移动,达到新的平衡 |
说法或表示法正确的是()
| A.由“C(石)→C(金);△H=" +1.9" kJ/mol ”可知金刚石比石墨稳定 |
| B.在101KPa时,1mol碳燃烧所放出的热量为碳的燃烧热 |
| C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g) = 2H2O(l);△H= -571.6kJ/mol |
| D.HCl和NaOH反应的中和热△H= -57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为△H= -(2×57.3)kJ/mol |
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是()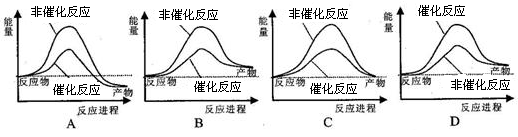
反应4A(s)+3B(g)  2C(g)+D(g),经2 mi
2C(g)+D(g),经2 mi n,B的浓度减少0.6 mol/L,对此反应速率的表示不正确的是()
n,B的浓度减少0.6 mol/L,对此反应速率的表示不正确的是()
A.在2 min内的反应速率用B表示为0.3 mol/(L·min)
B.在2 min内用C表示反应速率是0.2 mol/(L·min)
C.v (B)=3v(D)
D.v (A)="0.4" mol/(L·min)
反应Cl2+H2O HCl+HClO达平衡时,欲使HClO浓度增大,应加入()
HCl+HClO达平衡时,欲使HClO浓度增大,应加入()
| A.CaCO3 | B.HCl | C.NaOH | D.H2O |