下列含氯化合物有关的说法正确的是( )
| A.HClO是弱酸,所以NaClO是弱电解质 |
| B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D.电解NaCl溶液得到22.4LH2(标准状况),理论上需要转移NA个电子 |
某实验小组以H2O2分解为例,探究浓度、催化剂、温度对反应速率的影响。按照如下方案完成实验。下列说法不正确的是
| 编号 |
反应物 |
催化剂 |
温度 |
| ① |
10mL10% H2O2溶液 |
无 |
25℃ |
| ② |
10mL20% H2O2溶液 |
无 |
25℃ |
| ③ |
10mL20% H2O2溶液 |
无 |
40℃ |
| ④ |
10mL20% H2O2溶液 |
1mL0.1mol/LFeCl3溶液 |
40℃ |
A.实验④反应速率最快
B.实验①反应速率最慢
C.实验②速率小于实验④的速率,只是因为实验④加入了催化剂
D.加入催化剂,能增大活化分子百分数,从而加快化学反应速率
用NaOH溶液滴定盐酸时,由于滴定速度太快,当混合溶液变红时不知NaOH是否过量,判断它是否过量的方法是
| A.加入5mL盐酸再进行滴定 | B.返滴一滴待测盐酸 |
| C.重新进行滴定 | D.以上方法均不适用 |
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是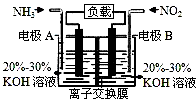
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.A电极上发生氧化反应,B为正极 |
| C.电极A极反应式为2NH3-6e-=N2+6H+ |
| D.当有2.24LNO2(标准状况)被处理时,转移电子为0.4mol |
常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液,下列说法中正确的是(忽略混合前后溶液体积变化)
| A.溶液的pH值:①>③>② |
| B.水电离出的c(OH-):③>①=② |
| C.①和③等体积混合后的溶液:c(CH3COOH)+c(CH3COO-)=0.1mol/L |
| D.②和③等体积混合后的溶液:c(Na+)=c(CH3COOH)+c(CH3COO-) |
现有常温下的四种溶液:①pH=11的氨水、②0.001mol/L的NaOH溶液、③pH=3的醋酸、④由水电离出的c(H+)=10-11mol/L的盐酸。下列有关叙述正确的是
| A.分别加水稀释10倍,四种溶液的pH:①>②>④>③ |
| B.将③、④分别稀释到pH =5,由水电离出氢离子的浓度均减小100倍 |
| C.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 |
| D.将①、④两种溶液等体积混合,所得溶液中:c(OH-):c(H+)<1 |