常温下,下列溶液中的微粒浓度关系正确的是( )
| A.新制氯水中加入固体NaOH:c(Na+) = c(Cl-) + c(ClO-) + c(OH‑) |
| B.pH = 8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-) > c(H2CO3) |
| C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl-) = c(NH4+) > c(OH‑) = c(H+) |
| D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+) – 2c(OH-) = c(CH3COO-) – c(CH3COOH) |
为了建设环境友好型社会,节能减排将成为我国政府目前工作的重点,因此节约能源与建设新能源是摆在当前的一个课题。针对这一现象,某化学学习研究性小组提出如下方案,你认为不够科学合理的是: ( )
| A.采用电解水法制取氢气作为新能源 |
| B.加大开发太阳能、水能、风能、地热能等能源力度,减少化石燃料的使用 |
| C.研制推广以乙醇为燃料的汽车 |
| D.生产、生活中,努力实现资源的循环利用 |
某气体的质量是9.5g,体积是5.6升(标准状况下),该气体的摩尔质量是
| A.38 | B.38g·mol-1 | C.19 | D.19g·mol-1 |
下图锥形瓶中装满了c mol·Lˉ1的Na2SO4溶液,经测定其中含有a mol SO42-,则锥形瓶容积为
A.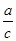 L L |
B.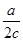 L L |
C.acL | D.2acL |
阿斯匹林(分子式为C9H8O4)是人们熟知的治感冒药,具有解热镇痛作用。 它的摩尔质量是
| A.148g | B.148g/mol | C.180g/mol | D.146g |
欲配制100ml 1.0 mol/L Na2SO4溶液,正确的方法是
① 将14.2 g Na2SO4 溶于100ml水中② 将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml③ 将20 ml 5.0 mol/L Na2SO4溶液用水稀释至100 ml
| A.①② | B.②③ | C.①③ | D.①②③ |