下列关于化学用语的表示正确的是( )
A.碘化铵的电子式: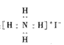 |
B.间二甲苯的结构简式: |
C.中子数为146、质子数为92的铀(u)原子: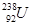 |
D.氯原子的结构示意图:  |
工业上以CuO和H2SO4为原料制备CuSO4·5H2O晶体。为确保制备过程中既不补充
水,也无多余的水分,所用硫酸溶液溶质的质量分数应为
| A.45.8% | B.57.6% | C.72.3% | D.无法确定 |
某溶液中由水电离生成的c(H+)=10-12 mol/L,下列各组离子一定不能大量共存的是
| A.Na+、AlO2-、Cl-、SO42- | B.Mg2+、Ca2+、HCO3-、Cl- |
| C.K+、Fe2+、SO42-、Br- | D.Fe3+、Ca2+、Cl-、NO3- |
2007年诺贝尔化学奖授予德国科学家格哈德·埃德尔是因为他在表面化学所作的开创性研究。下列选项与物质的表面特征无关的是
| A.用明矾来净水 |
| B.硫酸工业生产中送进沸腾炉的矿石被粉碎成细小的矿粒 |
| C.用还原铁粉和石棉绒混合与水蒸气反应制Fe3O4和H2 |
| D.配制FeCl3溶液时,将FeCl3固体溶于浓盐酸中再加水稀释 |
下列各组溶液中,不用其它试剂即可鉴别的是(注:NaAIO2可表示为Na[Al(OH)4])
| A.KOH Na2SO4 AlCl3 | B.Na2CO3 Ba(OH)2HCl |
| C.HCl NaAlO2 H2SO4 | D.Ca(OH)2 Na2CO3 BaCl2 |
室温下,有关四种溶液的叙述不正确的是(忽略溶液混合的体积变化)
| ① |
② |
③ |
④ |
|||||
| pH |
11 |
11 |
3 |
3 |
||||
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸
|