(本题共10分)
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是P能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满。请回答下列问题:
23.X、Y、Z第一电离能由小到大的顺序为______<______<______(填元素符号)。
24.E元素基态原子的电子排布式为________________________________。
25.XZ2的分子中含有 个π键。
26.Z氢化物的沸点比Q氢化物的沸点高,理由是_____ 。
27.将YH3通入灼热EZ中发现黑色固体变红色,生成物对大气不造成污染。请写出有关化学方程式 。
复分解反应的条件是生成_____________、_____________或____________。
化肥在农业生产中占有重要位置。国内外农学专家普遍认为,在其他生产因素不变的情况下,农作物施用化肥可增产40%-60%。合成氨工业可以提供大量的氮肥,是满足人类对粮食增长需求的非常重要的化学工业。
(1)在工业合成氨的反应中,由于该反应在常温常压下,慢得几乎不能觉察,要实现工业化非常困难,许多化学家为此进行了不懈的努力。他们先从温度和压强着手,温度升高对提高化学反应速率(填有利、不利或无关),增加压强对提高化学反应速率(填有利、不利或无关),科学家们虽然选择了合适的温度和压强,但效果不佳,仍无法投入工业化生产。德国化学家哈伯(Fritz Haber,1868-1934)通过努力,在使用合适催化剂的情况下终于解决了这个问题,实现了合成氨的工业化生产。你认为该反应能工业化生产的关键是
(2)合成氨是重要的人工固氮方法,除人工固氮外,还有自然固氮,闪电固氮就是自然固氮的一种方式,课堂上可用高压发生器模拟这一过程,装置如图所示: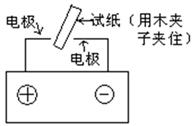
实验开始后,可以看到湿润的蓝色石蕊试纸变红色,请解释原因(用反应的化学方程式表示)
发生天然气井喷事故中喷发出的天然气含有硫化氢气体,请你用学到的知识回答下列问题:
(1)为防止井喷事故中更大的人员伤亡,抢救人员欲采用点火燃烧方法来除去有毒气体,试写出反应的化学方程式
(2)在石油钻井中,为防止井喷事故,要根据井下压强,将重晶石(密度4.5g/cm3左右)与泥浆按一定比例混合后灌入井中。写出重晶石的化学式试说明重晶石粉做压井材料的原因
(3)含硫地区钻井液的pH值应控制9.5以上,若用氢氧化钠溶液做控制液,写出发生反应的化学方程式
亚硝酸钠(NaNO2)是一种工业用盐,有像食盐一样的咸味,常被误食引起中毒。已知氢碘酸(HI)与NaNO2反应生成碘单质和一氧化氮气体。
(1)上述反应的离子方程式为。
(2)上述反应中,氧化剂是,发生氧化反应的物质是。
(3)根据上述反应,可以用试纸和生活中常见的物质进行实验,来鉴别亚硝酸钠和食盐。可选用的物质有:①自来水②碘化钾淀粉试纸③淀粉④白糖⑤食醋⑥白酒。进行实验时,必须选用的物质有(填写序号)。
将pH=13和pH=11的氢氧化钠溶液等体积混合,求混合后溶液的pH= 。