(本题共16分)
合成氨的原料气H2可通过反应CO(g)+H2O(g)  CO2 (g) +H2(g) 获取。
CO2 (g) +H2(g) 获取。
60.T℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 ,该温度下反应的平衡常数K值为 。
61.保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入固定容器中进行反应,下列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2) = 1 : 16 : 6 : 6
62.液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
①4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H2
③4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H3
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
63.美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂作为电极、加入碱性电解质溶液,其电池反应为4NH3+3O2=2N2+6H2O
①写出该燃料电池的正极反应式 。
②若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上9.75g锌,理论上至少需要消耗标准状况的氨气 L。
64.下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应。

65.金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体和沉淀生成。写出CH3MgCl水解的化学方程式 。
A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题: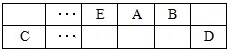
(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则ab(填“>"或“<”或“=”)
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,G (OH)n完全沉淀的pH是2.8,则ksp较大的是:(填化学式)
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是。
(6)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式。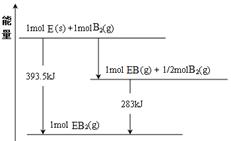
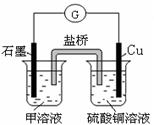
(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为。
某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
(1)A中制取Cl2的离子方程式.
(2)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和;
假设2:存在三种成分:NaHCO3和。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。 (3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为。
(3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为。
某种橡胶分解产物为碳氢化合物。对这种碳氢化合物做以下实验:
①若取一定量的橡胶完全燃烧,使燃烧后的气体通过干燥管,干燥管增重0.72克,再通过石灰水,使石灰水增重2.2克。
②经测定,该碳氢气体化合物的密度是相同状况下氢气密度的34倍。
③该碳氢化合物0.1 mol能和32克溴起加成反应。
④经分析,在③的生成物中,溴原子分布在不同的碳原子上,且溴代物中有一个碳原子在支链上。 (1)该碳氢化合物的结构简式是,名称
是 。
(2)该橡胶的结构简式是,名称是。
在恒温、恒压和使用催化剂的条件下,已知:在容积可变的密闭容器中,充入1 L含3 mol H2和1 mol N2的混合气体,反应达平衡时有a mol NH3生成,N2的转化率为b%。
(1)若在恒温、恒压和使用催化剂的条件下,在体积可变的密闭容器中充入x mol H2和y mol N2,反应达平衡时有3a mol NH3生成,N2的转化率仍为b%。则x=;
y=。
(2)在恒温、恒压和使用催化剂的条件下,设在体积可变的密闭容器中充入x mol H2、y mol N2和z mol NH3,若达平衡时N2转化率仍为b%,则x、y的关系为;z的取值范围为。
(3)在恒温[与(1)温度相同]和使用催化剂的条件下,在容积不可变的密闭容器中,充入1 L含3 mol H2和1 mol N2的混合气体,反应达平衡时N2的转化率为c%,则b、c的关系为(用“<”、“=”或“>”表示),理由是。
以色列科学家达尼埃尔·谢赫特曼因发现“准晶体”而独享2011年诺贝尔化学奖以及奖金。现在,准晶体已在很多应用领域“大展拳脚”,可用来制造不粘锅、发光二极管、热电转化设备等。
(1)铁在周期表中的位置,铝的原子结构示意图为;
(2)工业炼铝用的原料是(填Al2O3或AlCl3),不用另一种的原因是
;
(3)铜在潮湿的空气中会生成铜绿,写出该反应方程式
;
(4)用电解法制Fe(OH)2沉淀,下列可做电解质溶液的是
| A.纯净水 | B.NaCl溶液 | C.NaOH溶液 | D.CuCl2溶液 |