已知反应I2(g)+H2(g)  2HI(g) ΔH<0,下列说法正确的是( )
2HI(g) ΔH<0,下列说法正确的是( )
| A.降低温度,正向反应速率减小倍数大于逆向反应速率减小倍数 |
| B.升高温度将缩短达到平衡的时间 |
| C.达到平衡后,保持温度和容积不变,充入氩气,正、逆反应速率同等倍数增大 |
| D.达到平衡后,保持温度和压强不变,充入氩气,HI的质量将减小 |
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是
A.转移0.1mol电子时,a电极产生标准状况下O2 1.12L
B.b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH-
C.c电极上进行还原反应,B电池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
下列说法中正确的是
| A.8NH3(g)+6NO2(g)=7N2(g)+12H2O(g);ΔH<0,则该反应一定能自发进行 |
| B.提取海带中碘元素时,为将I-完全氧化为I2,用HNO3作氧化剂比用H2O2效果好 |
| C.原电池放电过程中,负极质量一定减轻,正极的质量一定增加 |
| D.由于Ksp(MgCO3)<Ksp[Mg(OH)2],因此水垢中MgCO3会逐渐转化为Mg(OH)2 |
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以A1作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:电池:Pb(s)+ PbO2(s)+2H2SO4(aq)= 2PbSO4(s)+ 2H2O(l)
电解池:2Al + 3H2O  Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )
Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )
| 原电池 |
电解池 |
|
| A |
H+移向Pb电极 |
H+移向Pb电极 |
| B |
每消耗3molPb |
生成2molAl2O3 |
| C |
正极:PbO2+4H++2e-=Pb2++2H2O |
阳极:2Al+3H2O-6e-=Al2O3+6H+ |
| D |
 |
 |
①②③④ 四种金属片两两相连浸入稀硫酸中都可组成原电池 ,①②相连时,外电路电流从②流向① ;①③相连时,③为正极,②④相连时,②有气泡逸出 ;③ ④ 相连时,③ 的质量减少 ,据此判断这四种金属活动性由大到小的顺序是
A ①③②④ B ①③④②
C ③ ④ ②①D ③ ① ②④
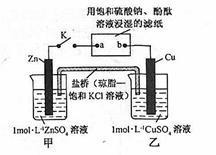
将右图所示实验装置的 K 闭合,下列判断正确的是
| A.Cu 电极上发生还原反应 |
| B.电子沿 Zn→a→b→Cu 路径流动 |
| C.片刻后甲池中c(SO42-)增大 |
| D.片刻后可观察到滤纸b点变红色 |