下列实验事实不能用平衡移动原理解释的是( )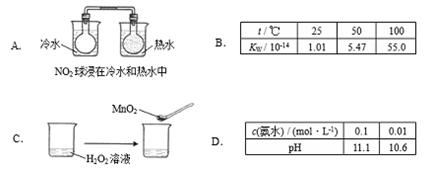
将0.01mol下列物质分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子总浓度的大小顺序是(溶液体积变化忽略不计):①Na2O2②Na2O ③Na2CO3④NaCl
| A.①>②>③>④ | B.①>②>④>③ | C.①=②>③>④ | D.①=②>③=④ |
下列热化学方程式或离子方程式中,正确的是:( )
| A.甲烷的标准燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ·mol-1 |
|
| B.500℃、30MPa下,将0.5mol N2和1.5molH2经过催化剂生成NH3(g)放热19.3kJ,其
500℃,30MPa |
C.氯化镁溶液与氨水反应:Mg2++2OH- = Mg(OH)2↓ |
| D.氧化铝溶于NaOH溶液:Al2O3+2OH- = 2AlO2-+H2O |
在pH=1的溶液中能大量共存的一组离子或分子是 ( )
| A.Na+、Mg2+、ClO-、NO3- | B.Al3+、 NH4+、 Br -、Cl- |
| C.K+、Cr2O72-、CH3CH2OH、SO42- | D.Na+、K+、SiO32-、Cl- |
FeS与一定浓度HNO3反应,生成Fe2(SO4)3.Fe(NO3)3.NO2.NO和H2O,当NO2和NO的体积为1∶1时实际参加反应的FeS与HNO3的物质的量之比是()
A.4∶9 |
B.2∶9 | C.2∶11 | D.1∶7 |
氢氧燃料电池是一种污染小,效率高的新型化学电源 ,可用于航天器上,其总反应的化学方程式为:
,可用于航天器上,其总反应的化学方程式为: ,该电池的负极反应可表示为(电解质溶液为稀硫酸)()
,该电池的负极反应可表示为(电解质溶液为稀硫酸)()
A.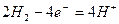 |
B.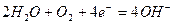 |
C.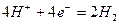 |
D. |