1862年,比利时化学家索尔维发明了氨碱法制碱,1926年,我国化学家侯德榜创立了更为进侯德榜制碱法,也叫联合制碱法,两种制碱的生产流程可简要表示如下图:


(1)向沉淀池中通入CO2和氨气时,应先通入氨气的原因是 。
(2)沉淀池中发生反应的化学反应方程式是
从沉淀池中分离沉淀的操作是 。
(3)氨碱法生产流程示意图中的Y是 ,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为 。
(4)联合制碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确是 (选填编号)。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气能增大NH4+的浓度,使氯化铵更多析出
c.加入食盐细粉能提高Na+的浓度, 使NaHCO3结晶析出
d.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(5)联合制碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环Ⅰ,联合制碱法的另一项优点是 。
(6)产品纯碱中含有碳酸氢钠,可以用加热分解的方法测定产品中纯碱的质量分数,已知样品质量为ag,加热至质量不再改变时称重为bg,则纯碱的质量分数为 。
(1)非金属单质A是实验室里常用的惰性电极材料,A元素原子基态时的电子排布图为。
(2)B原子基态时2p原子轨道上有3个未成对电子,下列叙述正确的是(填字母序号)
a.B的气态氢化物的沸点在同族元素的氢化物中最低
b.B的第一电离能、电负性都比A的大
c.A的气态氢化物比B的气态氢化物稳定
d.A的含氧酸一定比B的含氧酸酸性强
(3)铜单质及其化合物在很多领域有重要的用途,如超细铜粉可应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下:
①[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从小到大的顺序为:。
②SO42-空间构型是。写出一种与SO32-互为等电子体的分子。
③NH4CuSO3中的金属阳离子的结构示意图为。
含 Mg2+、Al3+溶液10mL,向其中滴加a mLC1mol·L—1NaOH之后,改成滴加C2mol·L—1HCl,所得沉淀Y(mol)与加入的试剂总体积V(mL)间的关系如右图所示。据此,回答下列问题:
(1)C~D过程中的离子方程式;
(2)n(Mg2+)/ n(Al3+) =;
(3)C1/C2=;
(4)所加入NaOH溶液的体积a=mL。
构建知识网络是学习化学的重要方法。下列物质的转化网络可以概括几类反应,其中A、B、D、E、M、N、X、Y均表示一种中学化学中常见的无机物,反应②、③、④、⑤
的生成物可以是一种或几种。请回答下列问题: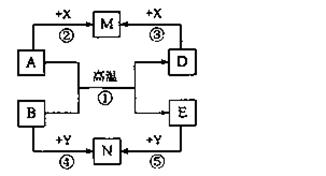
(1)A为固态非金属单质时,若反应①用于生产半导体材料,则M为________ Y为。
(2)A为金属单质时,若M为NaAlO2溶液,N为棕黄色溶液,反应⑤的离子方程式是。
(3)反应①在常温下进行时,也有很多组物质符合网络图中的转化关系,请列举一例(要求反应①中只有一种元素的化合价发生变化):A、B的化学式分别是。
某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子.该厂拟定如图所示的废水处理流程。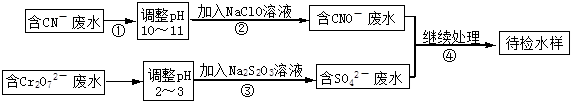 回答以下问题:
回答以下问题:
(1)步骤②发生反应的离子方程式可表示如下:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,上述离子方程式可能的配平系数有多组,请回答:
①方程式中e : f的值为(填选项标号)。
| A.1 | B.1/2 | C.2 | D.不能确定 |
②若d=e=1,则b=。
③若反应中转移0.6mol电子,则生成的气体在标况下的体积是。
(2)步骤③中反应时,每0.4molCr2O72-转移2.4mol的电子,该反应的离子方程式为。
(3)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少. 请用离子方程式表示出现上述颜色变化的原因。
①产生蓝色沉淀的离子方程式为,②后又变黑色沉淀的离子方程式为。
(4)铜是与人类关系非常密切的有色金属,已知常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生;2Cu+=" Cu+" Cu2+。大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH等。
①写出CuH在过量稀盐酸中有气体生成的离子方程式。
②将CuH溶解在适量的稀硝酸中,完成下列反应的化学方程式: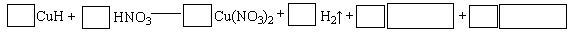
某强酸性溶液X中含有Ba2+、Al3+、SiO32-、NH4+、Fe2+、Fe3+、CO32-、SO42-、NO3-中的一种或几种离子,取该溶液进行连续实验,能实现如下转化:
根据以上信息,请回答下列问题:
(1)溶液X中除H+外肯定含有的离子是,不能确定是否含有的离子是,若要确定不能确定的阳离子是否存在,最可靠方法是:
。
(2)沉淀E的化学式为。
(3)反应①、②、③、④中,属于氧化还原反应的是(填序号)
(4)写出步骤①中生成气体A的离子方程式:。