某强酸性溶液X中含有Ba2+、Al3+、SiO32-、NH4+、Fe2+、Fe3+、CO32-、SO42-、NO3-中的一种或几种离子,取该溶液进行连续实验,能实现如下转化:
根据以上信息,请回答下列问题:
(1)溶液X中除H+外肯定含有的离子是 ,不能确定是否含有的离子是 ,若要确定不能确定的阳离子是否存在,最可靠方法是:
。
(2)沉淀E的化学式为 。
(3)反应①、②、③、④中,属于氧化还原反应的是 (填序号)
(4)写出步骤①中生成气体A的离子方程式: 。
工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 |
平衡常数 |
温度℃ |
||
| 500 |
700 |
800 |
||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) |
K1 |
2.5 |
0.34 |
0.15 |
②H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g) |
K2 |
1.0 |
1.70 |
2.52 |
③3H2(g)+CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) |
K3 |
请回答下列问题:
(1)反应②是(填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示)。
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O (g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时V正V逆(填“ > ”、“=”或“<”)。
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是_____________(填序号)。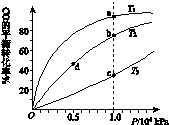
A.温度:T1>T2>T3
B.正反应速率:υ(a)>υ(c) , υ(b)>υ(d)
C.平衡常数:K(a)>K(c) , K(b)=K(d)
D.平均摩尔质量:M(a)>M(c) , M(b)>M(d)
在稀硫酸酸化的含6 mol KI溶液中逐滴加入KBrO3溶液,整个过程中含碘物质与所加入KBrO3物质的量的关系如图。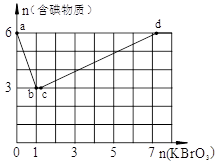
请回答下列问题:
(1)b点时,对应含碘物质的化学式为。
(2)b→c过程中,仅有一种元素发生化合价变化,写出该反应的化学方程式并标出电子转移方向与数目。
(3)当n(KBrO3)=4mol时,体系中对应含碘物质的化学式为。
(4)酸性条件下,Br2、IO3-、BrO3-、I2氧化性由强到弱的顺序为。
(5)在稀硫酸酸化的KBrO3溶液中不断滴入淀粉KI溶液,边滴边振荡。则实验过程中的可能观察到的现象为。
I.莽草酸是有效应对H5N1型禽流感病毒的药物“达菲”的重要成分。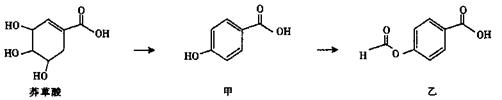
(1)莽草酸中可发生加成反应的官能团为______ (填名称)。
(2)等物质的量的莽草酸、甲、乙分别与NaOH溶液完全反应,消耗NaOH的物质的量之比为______。
(3)写出符合以下条件的莽草酸的同分异构体的结构简式____________。
(i)链状结构,含三种氢,有两个甲基。
(ii)能与NaOH溶液反应。
II.PET为聚合物,用于生产矿泉水塑料瓶。PET生产流程如下图: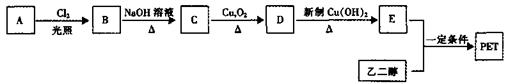
已知:A、B、C、D、E都是苯的对位二元取代物,A为烃,E与邻苯二甲酸互为同分异构体。
(4)B→C的反应类型为______。
(5)能鉴别C和D的试剂是______。
(6)E与乙二醇反应生成PET的化学方程式为____________。
科技日报报道:辉钼(MoS2)在纳米电子设备制造领域比硅或富勒烯(如C60)更有优势。从不同角度观察MoS2的晶体结构见图。已知:Mo位于第五周期VIB族。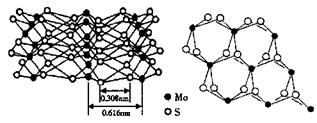
(1)晶体硅中硅原子的轨道杂化类型为______。
(2)电负性:C______S(填“>”或“<”)。
(3)晶体硅和C60比较,熔点较高的是______。
(4)Mo元素基态原子的价电子排布式为____________。
(5)根据MoS2的晶体结构回答:
①每个Mo原子周围距离最近的S原子数目为______。
②Mo-S之间的化学键为______(填序号)。
A极性键;B非极性键;C配位键;D金属键;E范德华力
③MoS2纳米粒子具有优异的润滑性能,其原因是______。
电石是重要的工业原料,电石渣[主要成分Ca(OH)2]的综合利用体现了绿色化学思想。
(1)用电石为原料可生产聚氯乙烯。聚氯乙烯的结构简式为____________。
(2)电石渣可用于除去垃圾焚烧炉烟道气中的SO2生成CaSO4,反应中的氧化剂是____________ (填名称)。
(3)电石渣可用于生产纯碱。涉及的部分化学反应为:
(i)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(ii)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
此生产过程中,可循环利用的物质有____________ (填化学式)。
(4)用电石渣处理酸性含铬(Cr2O72—)电镀废水的流程如下: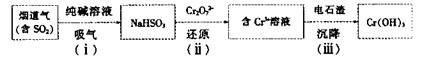
①步骤(i)发生反应的化学方程式为__________________
②步骤(ii)发生反应的离子方程式为__________________
③步骤(iii)调节溶液pH为8,则残留Cr3+的浓度为______(Ksp[Cr(OH)3]=6.3×10—31)。