(1)某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 |
CO32—、SiO32—、AlO2—、Cl- |
| 阳离子 |
Al3+、Cu2+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y的体积(V)的关系如图所示。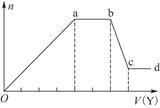
①若Y是盐酸,则溶液中含有的金属阳离子是_________________________________,
ab段发生反应的总离子方程式为___________________________________
表中Oa段与Y溶液反应的离子的物质的量之比为__________[要标明离子符号,如n(Na+)]。
②若Y是NaOH溶液,则bc段反应的离子方程式为______________________________
若不考虑离子的水解因素,忽略H+和OH-的影响,且溶液中只存在4种离子,则它们的离子个数比为___________________________________[按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列]。
(2)锡为第ⅣA族元素,锡的单质和化合物与某些物质的化学性质上有许多相似之处。已知锡元素具有如下性质:
Sn4++Sn=2Sn2+;
2Sn2++O2+4H+=2Sn4++2H2O;
2H++SnO22— Sn(OH)2
Sn(OH)2 Sn2++2OH-。
Sn2++2OH-。
试回答:
①锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的离子方程式:______________________________________,
②将①中溶液蒸干后继续加热所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是(分子式)__________。
③若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2, 该碱是__________。
【化学—化学与技术】
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于__________硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂添加顺序为__________,原因是______________________________________________________。
(3)目前常用阴、阳离子交换树脂来进行水的软化,水中的Ca2+、Mg2+与交换树脂的__________起离子交换作用。当阴离子交换树脂失效后可放入___________溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题: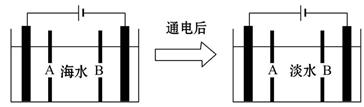
①阳离子交换膜是指_________(填“A”或“B”)。
②写出通电后阳极区的电极反应式:_____________________________;
阴极区的现象是:_____________________________________________。
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)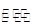 2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①2SO2(g)+O2(g)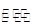 2SO3(g)的正反应为反应(填“放热”、“吸热”);若在恒温、恒容条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”、“向右”或“不”);
2SO3(g)的正反应为反应(填“放热”、“吸热”);若在恒温、恒容条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”、“向右”或“不”);
②若温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1_______K2;若反应进行到状态D时,v(正)_______v(逆)(填“>”、“<”或“=”)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
右图是一定的温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:______________。(ΔH的数值用含字母a、b的代数式表示)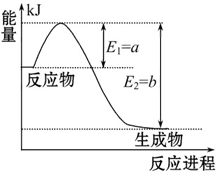
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25 ℃下, 2.0×10-3 mol·L-1的NaCl溶液中逐滴加入适量的2.0×10-4 mol·L-1硝酸银溶液,白色沉淀生成(填“有”、“没有”)。通过计算解释原因______________________________,向反应后的浊液中,继续加入2.0×10-3mol·L-1的NaI溶液,看到的现象是_____________________________,产生该现象的原因是_____________(用离子方程式表示)。(已知25 ℃时Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16)
[物质结构与性质]
物质结构的多样性让人类使用的材料精彩纷呈。
(1)图是原子序数相连的七种短周期元素第一电离能示意图。其中硼元素是(填图中元素代号)。
(2)②③两种元素组成的化合物与③④两种元素组成的化合物为等电子体,写出与其等电子体的一种离子化学式
(3)乙二酸俗名草酸,是最简单的有机二元酸之一,结构简式为 草酸钠晶体中存在(填图中元素代号)。
草酸钠晶体中存在(填图中元素代号)。
A金属键 B非极性键 C键 D范德华力 E氢键 F离子键
(4)含氧酸可电离的氢原子来自羟基,碳酸的结构式可表达为;若碳酸 中的碳氧原子都在同一平面,则碳原子的杂化类型是。
(5)PtCl4和氨水反应可获得PtCl4• 4NH3,PtCl4•4NH3是一种配合物。100mL0.1mol•L-1PtCl4•4NH3 溶液中滴加足量AgNO3溶液可产生2.87g白色沉淀。该配合物溶于水的电离方程式为。
(14分)铅及其化合物工业生产及日常生活具有非常广泛的用途。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH=" a" kJ/mol
PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH=" b" kJ·mol-1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH=" c" kJ·mol-1
反应3PbS(s) + 6O2(g) = 3PbSO4(s) ΔH="kJ" ·mol-1(用含a,b ,c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g)  Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
| 温度 |
300 |
727 |
1227 |
| lgK |
6.17 |
2.87 |
1.24 |
①该还原反应的△H0(选填:“>”“<”“=”)。
②当IgK=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为。
(3)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图所示,该电池正极的电极反应式为。
(4)PbI2:可用于人工降雨。取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00mLPbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图)。加入酚酞指示剂,用0.0025mol·L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL。可计算出t℃时PbI2 Ksp为。
(5)铅易造成环境污染,水溶液中的铅存在形态主要有6种,它们与pH关系如图所示,含铅废水用活性炭进行处理,铅的去除率与pH关系如图所示。
①常温下,pH=11→13时,铅形态间转化的离子方程式为。
②用活性炭处理,铅的去除率较高时,铅主要应该处于(填铅的一种形态的化学式)形态。
A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)D元素在元素周期表中的位置,该元素常见氧化物有 和(写出化学式)
(2)写出B、C单质生成E的化学方程式: 。
(3)12克A单质充分燃烧后的产物通人1L 1mol/LNaOH溶液中,所得溶液的溶质为,其物质的量为mol。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式