某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含离子的化学组分及其浓度如下表:
| 离子 |
H+ |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol·L-1 |
未测定 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断试样的pH= 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g)="CO" (g) △H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
A.Ca(OH)2 B.Na2CO3 C.CaCl2 D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化
①若1mol空气含0.8molN2和0.2molO2,汽缸中的化学反应式为N2 (g)+O2(g) 2NO(g) △H
2NO(g) △H 0,1300℃时将1mol空气放在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,其原因是 。
0,1300℃时将1mol空气放在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,其原因是 。
②目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为 。
③汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g),已知该反应的△H 0,判断该设想能否实现并简述其依据: 。
0,判断该设想能否实现并简述其依据: 。
(12分)Mn(OH)2常用作油漆催干剂。向MnSO4溶液加入NaOH溶液,待沉淀完全后,过滤,洗涤,烘干即可制得Mn(OH)2。
(1)已知:常温下Mn(OH)2的Ksp=1.0×10-15。如果要使溶液中Mn2+沉淀完全,则应该保持溶液中c(OH—)≥mol·L—1[当c(Mn2+)≤10-5mol/L时,即可认为溶液中Mn2+沉淀完全]。
(2)Mn(OH)2还可以通过MnO2与二氧化硫气体充分接触,再与石灰乳反应制得,写出该反应的总的化学方程式。
(3)一种含Mn2+的结晶水合物组成为AxMnyBz·mH2O(A表示一种阳离子,B表示一种阴离子)。现称取39.10 g晶体配成100 mL溶液X,取20 mL溶液X,向其中加入足量的氢氧化钠溶液,加热,得到896 mL气体(标准状况);另取20 mL溶液X,向其中加入盐酸,无沉淀产生,再加入BaCl2溶液,产生白色沉淀,过滤,洗涤,烘干,得到固体9.32 g。
①A、B的离子符号分别为、。
②通过计算确定该结晶水合物的化学式(写出计算过程)。
铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水。
(1)还原沉淀法是处理含Cr2O72—和CrO42—工业废水的一种常用方法,其工艺流程为:
其中第I步存在平衡:2CrO42—(黄色)+2H+ Cr2O72— (橙色)+H2O
Cr2O72— (橙色)+H2O
①若平衡体系的pH=2,该溶液显色。
②根据2CrO42—+2H+ Cr2O72— +H2O,设计下图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为,图中右侧电极连接电源的极,其电极反应式为。
Cr2O72— +H2O,设计下图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为,图中右侧电极连接电源的极,其电极反应式为。
③第Ⅱ步反应的离子方程式:,向Ⅱ反应后的溶液加一定量NaOH,若溶液中c(Fe3+)=2.0×10—12mol·L—1,则溶液中c(Cr3+)=mol·L—1。(已知Ksp[Fe(OH)3]=4.0×10—38,Ksp[Cr(OH)3]=6.0x10—31)。
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。完成该反应的化学方程式:
(3)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。B点时剩余固体的成分是(填化学式)。
【化学——选修2:化学与技术】(15分)煤是一种重要的化石能源。请回答:
(1)煤的加工包括干馏、_________和液化,煤的液化技术又分为_________和_________。
(2)干熄焦技术是将炼焦炉推出的约l000 的赤热焦炭,在熄焦室中被与其逆流的冷惰性气体熄灭,逆流通人惰性气体的原因是_________。
的赤热焦炭,在熄焦室中被与其逆流的冷惰性气体熄灭,逆流通人惰性气体的原因是_________。
(3)某工厂每天要烧掉含硫1.6%的烟煤200吨,排放出大量的SO2,如果将这些SO2回收利用,那么理论上每年(按365天计)可生产98%的浓硫酸_________吨。
(4)石膏法脱硫是烟气脱硫技术中最成熟的一种方法,工艺如图,吸收、氧化过程的化学方程式为____。实际生产时采用石灰石浆液作SO2吸 收剂而不用熟石灰吸收SO2,主要原因是_________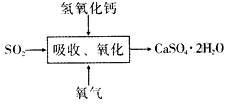
(5)煤燃烧产生的CO2在光能和光催化剂存在的条件下可与H2O(g)转化为CH4和O2,反应的化学方程式为_________。紫外光照射时,等量的CO2和H2O(g)在不同催化剂(I、Ⅱ)作用下,CH4产量随光照时间的变化如图所示,光照t小时后催化剂Ⅱ作用下CH4的产量开始高于催化剂I,其原因可能是_________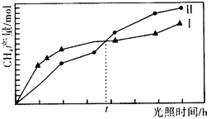
(14分)苯乙烯(C6H5CH=CH2)是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等。工业上以乙苯(C6H5CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:
C6H5CH2CH3(g)  C6H5CH=CH2(g)+H2(g)
C6H5CH=CH2(g)+H2(g)  H
H
(1)已知:H2和CO的燃烧热( H)分别为-285.8 kJ.mol
H)分别为-285.8 kJ.mol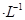 和-283.0 kJ.mol
和-283.0 kJ.mol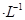 ;
;
C6H5CH2CH3(g)+CO2 (g) C6H5CH=CH2(g)+CO(g)+H2O(l)
C6H5CH=CH2(g)+CO(g)+H2O(l) H=+114.8 kJ·mol-1
H=+114.8 kJ·mol-1
则制取苯乙烯反应的 H为_________
H为_________
(2)向密闭容器中加入1 mol乙苯,在恒温恒容条件下合成苯乙烯,达平衡时,反应的能量变化为QkJ。下列说法正确的是 _________。
| A.升高温度,正反应速率减小,逆反应速率增大 |
| B.若继续加入1 mol乙苯,苯乙烯转化率增大 |
| C.压缩体积,平衡逆向移动,反应物浓度增大,生成物浓度减小 |
| D.相同条件下若起始加入1 mol苯乙烯和1 mol氢气, |
达平衡时反应能量变化为( H-Q)kJ
H-Q)kJ
(3)向2 L密闭容器中加入1 mol乙苯发生反应,达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示。700 时,乙苯的平衡转化率为_______,此温度下该反应的平衡常数为 ______;温度高于970
时,乙苯的平衡转化率为_______,此温度下该反应的平衡常数为 ______;温度高于970 时,苯乙烯的产率不再增加,其原因可能是_________。
时,苯乙烯的产率不再增加,其原因可能是_________。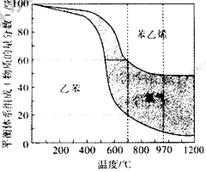
(4)含苯乙烯的废水排放会对环境造成严重污染,可采用电解法去除废水中的苯乙烯,基本原理是在阳极材料MOx上生成自由基MOx(OH),其进一步氧化有机物生成CO2,该阳极的电极反应式为_________,若去除0.5 mol苯乙烯,两极共收集气体_________mol。
【化学选修2-化学与技术】以硼镁矿(2MgO·B2O3·H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如下:
(1)由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施为________________________________________。
(2)“浸出液”显酸性,含有H3BO3、Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时,向浸出液中依次加入适量目H2O2和MgO,可以除去的杂质离子为_________,H2O2的作用为_________(用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的为_______。
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图所示,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收 MgSO4.H2O,应采取的措施是将“母液”蒸发浓缩,____。
(5)已知25℃时,硼酸(H3BO3)溶液中存在如下平衡:
下列说法正确的是_____________(填选项字母)。
| A.碳酸钠溶液滴入硼酸溶液中能观察到有气泡产生 |
| B.碳酸钠溶液滴入醋酸溶液中能观察到有气泡产生 |
| C.等浓度碳酸溶液和硼酸溶液的pH:前者>后者 |
| D.等浓度碳酸钠溶液和醋酸钠溶液的pH:前者>后者 |