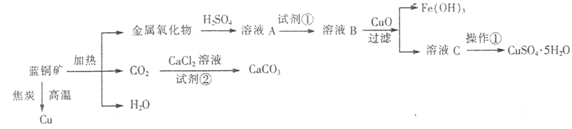
蓝铜矿主要含xCuCO3·yCu(OH)2,还含有少量Fe的化合物,工业上以蓝铜矿为原料制备Cu、CaCO3和CuSO4.5H2O。具体方法步骤如下:
已知:
| 金属离子 |
Fe3+ |
Fe2+ |
Cu2+ |
|
| pH |
氢氧化物开始沉淀 |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀 |
3.2 |
9.0 |
6.7 |
|
(1)蓝铜矿的主要成分与焦炭高温条件可以生成铜、二氧化碳和水,写出该反应的化学方程式 。
(2)从下列所给试剂中选择:实验步骤中试剂①为 (填代号)。
a.KMnO4 b.K2Cr2O7 c.H2O2 d.氯水
(3)在溶液B中加入CuO的作用是调节溶液pH,则pH的范围为 。
(4)由溶液C获得CuSO4.5H2O,需要经过加热蒸发浓缩、冷却结晶、过滤等操作,加热蒸发至 时停止加热。
(5)制备CaCO3时,应向CaCl2溶液中先通人(或加入)试剂②,则试剂②可以是 (填代号);
a.氨水 b.盐酸 c.水蒸气 d.NaOH溶液
如果不加人试剂②,则CaCl2溶液不能与CO2反应生成CaCO3,请依据难溶电解质的沉淀溶解平衡原理分析可能的原因 。
(6)为确定试剂①的用量,需测定溶液A中Fe2+的浓度。实验操作为:准确量取20.00mL 溶液A于锥形瓶中,用0.01200 mol/L的酸性KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液15.00 mL,则溶液A中Fe2+的浓度为 。
有一瓶无色澄清溶液,其中仅可能含有H+、Na+、Mg2+、Ba2+、Cl—、SO42—、CO32—离子。现进行如下实验:
①用pH试纸检验溶液,发现溶液呈强酸性;
②取部分溶液逐滴加入稀NaOH溶液,使溶液从酸性变为碱性,无沉淀生成;
③取少量②中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生。
根据上述实验事实确定:该溶液中肯定存在的离子有 ,肯定不存在的离子有 ;可能存在的离子有
按要求回答下列问题。
(1)把2.3 g钠溶于73.8 g水后所得溶液中Na+与H2O分子的个数比是 。
(2)在甲、乙、丙、丁四个烧杯内分别放入0.1 mol的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100 mL水,搅拌,使固体完全溶解,则甲、乙、丙、丁中溶液的质量分数由小到大的顺序是 。(填甲、乙、丙、丁,中间以<或=连接)
(3)将钠、镁、铝各0.4 mol分别放入100 mL 1mol/L的盐酸中,同温同压下产生的气体体积比为 。
(4)将物质的量之比为2:3:4的N2、O2、CO2混合气体通过Na2O2后,气体体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为 。
(5)从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4 + 5FeS2 + 12H2O ="=" 7Cu2S + 5FeSO4 + 12H2SO4。(已知FeS2中Fe显+2价),还原剂是 (填化学式),Cu2S是 (选填“还原剂、氧化剂、还原产物、氧化产物或非氧化还原产物”),当有5 mol FeS2发生反应时,有 mol电子转移;1.4 mol硫酸铜可以氧化 mol的硫。
根据实验事实,把下列化学方程式改写成离子方程式。
澄清石灰水中加入少量二氧化碳,溶液变浑浊:Ca(OH)2+CO2=CaCO3↓+H2O,离子方程式
向氯化镁溶液中滴入氢氧化钠溶液,产生白色的沉淀:MgCl2+2NaOH=Mg(OH)2↓+2NaCl,离子方程式
向盐酸溶液中加铁:Fe+2HCl=FeCl2+H2↑,离子方程式
钠与水反应时产生的各种现象如下:
①钠浮在 原因是 ;
②钠熔化成 原因是 ;
③小球 游动,原因是 ;
④发出嘶嘶的声音,原在是 ;
⑤滴入酚酞后溶液显 色,原因是 。
在反应2CuO+C 2Cu+CO2↑中____元素化合价升高______电子,是________剂,被_______,发生_____反应,________元素化合价降低_______电子,是_______剂,被_______,发生________反应。
2Cu+CO2↑中____元素化合价升高______电子,是________剂,被_______,发生_____反应,________元素化合价降低_______电子,是_______剂,被_______,发生________反应。