绿色化学的核心是反应过程的绿色化,即要求原料物质中的所有原子完全被利用且全部转入期望的产品中,下列过程不符合这一思想的的是( )
A.甲烷、CO合成乙酸乙酯:2CH4+2CO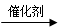 CH3COOCH2CH3 CH3COOCH2CH3 |
B.烯烃与水煤气发生的羰基合成反应:RCH=CH2+CO+ H2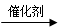 RCH2CH2CHO RCH2CH2CHO |
C.甲烷与氯气反应制氯仿:CH4+3Cl2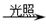 CHCl3+3HCl CHCl3+3HCl |
| D.乙烯合成聚乙烯 |
某溶液可能含有Na+、Ag+、Al3+、S2-、CO 、NO
、NO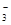 等离子中的数种。向此溶液中加入稀盐酸,有浅黄色沉淀和气体出现。根据以上实验现象,下列结论中正确的是( )
等离子中的数种。向此溶液中加入稀盐酸,有浅黄色沉淀和气体出现。根据以上实验现象,下列结论中正确的是( )
A.此溶液中一定有S2-、CO 、Na+ 、Na+ |
B.此溶液中一定有S2-、Na+、NO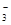 |
C.此溶液中一定有Na+、Al3+、NO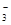 |
D.此溶液中一定有S2-、Na+,至少有CO 或NO 或NO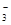 中的一种 中的一种 |
在新制的氯水中存在下列平衡:Cl2+H2O?H++Cl-+HClO,若向氯水中加入少量Na2CO3粉末,溶液中发生的变化是( )
| A.pH增大,HClO浓度减小 | B.pH减小,HClO浓度增大 |
| C.pH增大,HClO浓度增大 | D.pH减小,HClO浓度减小 |
下列是某同学对相应反应的方程式所作的评价,其中评价合理的是( )
| 编号 |
化学反应 |
离子方程式 |
评价 |
| A |
碳酸钙与醋酸反应 |
CO+2CH3COOH=== 2CH3COO-+H2O+CO2↑ |
错误,碳酸钙是弱电解质,不应写成离子形式 |
| B |
氢氧化钠溶液中通入过量CO2 |
OH-+CO2===HCO |
错误,通入过量CO2应生成CO |
| C |
碳酸氢钠的水解 |
HCO+H2O===H2CO3+OH- |
正确 |
| D |
等物质的量的FeBr2和Cl2反应 |
2Fe2++4Br-+2Cl2="2" Fe3++2Br2+4Cl- |
正确 |
下列离子方程式中,正确的是( )
| A.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO+Ba2++2OH-===BaCO3↓+2H2O |
| B.氢氧化铜沉淀溶解在浓氨水中:Cu2++4NH3·H2O===Cu(NH3)+4H2O |
| C.NaNO2溶液中加入酸性KMnO4溶液:2MnO+5NO+6H+===2Mn2++5NO+3H2O |
| D.Fe(NO3)3溶液加入过量的HI溶液:2Fe3++2I-===2Fe2++I2 |
下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
| A.2.4 g金属镁变为镁离子时失去的电子数为0.1 NA |
| B.1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质的粒子数相等 |
| C.在标准状况下,22.4 L CH4与18 g H2O所含有的电子数均为10 NA |
| D.CO和N2为等电子体,22.4 L CO气体与1 mol N2所含的电子数相等 |