在浓度均为6 mol·L-1的盐酸和硫酸各100 mL溶液中,分别加入等质量的铁粉,充分反应后生成气体体积比为2∶3,则加入铁粉的质量是( )
| A.11.2 g | B.25.2 g | C.16.8 g | D.33.6 g |
如图所示,在一熟苹果切片上分别滴上1滴碘水和银氨溶液,颜色变化如图所示,根据这些实验现象的下列推断正确的是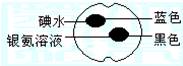
| A.熟透的苹果中含有脂肪 |
| B.熟透的苹果中不含淀粉 |
| C.熟透的苹果中含有还原性的糖 |
| D.熟透的苹果中不含还原性的糖 |
下列食品添加剂与类别对应正确的一组是
| A.着色剂-亚硝酸盐 | B.疏松剂—碳酸氢铵 |
| C.调味剂-苯甲酸钠 | D.防腐剂-醋酸 |
关于维生素C的下列说法中不正确的是
| A.易溶于水,水溶液显酸性 |
| B.维生素C也称为抗坏血酸,在人体内有重要功能 |
| C.在水溶液中容易被还原 |
| D.新鲜的水果和蔬菜中含有大量维生素C |
只用食盐、食醋、纯碱三种家庭厨房中的常见物质,你无法完成的实验是
| A.检验自来水中是否含氯离子 | B.鉴别食盐和纯碱 |
| C.检验鸡蛋壳能否溶于酸 | D.除去热水瓶中的水垢 |
下列反应可用于测定患糖尿病者尿液中含葡萄糖的是
| A.加入金属钠看是否放出H2 |
| B.与新制碱性Cu(OH)2悬浊液混合煮沸看是否有红色沉淀 |
| C.放置后看是否有白色晶体生成 |
| D.加苯振荡、静置后,看是否分层 |