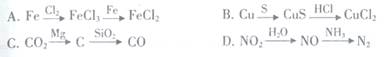下列分子中所有原子未全部满足最外层为8个电子结构的是( )
| A.CCl4 | B.CO2 | C.HCl | D.PCl3 |
下列物质所含粒子数为0.1NA(NA为阿伏加德罗常数的值)的是
| A.0.1 mo1 Na2O2所含的阴离子 |
| B.1 L0.1 mol·L-1氨水中的NH4+ |
| C.12.5mL 16 mo1·L-1的浓硫酸能溶解的Cu |
| D.4.6g N02气体所含的分子 |
Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)]。下列说法不正确的是
| A.可用如下方法除去污水中的Hg2+: FeS(s)+ Hg2+(aq)=HgS(s)+Fe2+(aq) |
| B.当溶液pCl保持在1,pH在6~8时,汞元素主要以HgCl42-形式存在 |
| C.HgCl2是一种强电解质,其电离方程式是:HgCl2=HgCI++Cl- |
| D.当溶液pH保持在5,pCl由2改变至6时.可使HgCl2转化为Hg(OH)2 |
NO2、O2和熔融KNO3,可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。下列说法不正确的是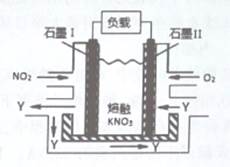
| A.NO2在石墨I附近发生氧化反应 |
| B.该电池放电时N03-向石墨I电极迁移 |
| C.石墨Ⅱ附近发生的反应:O2+4e-+2N205=4N03- |
| D.相同条件下,放电过程中消耗的NO2和O2的体积比为l:4 |
下述实验设计合理的是
| 选项 |
实验目的 |
实验设计 |
| A |
检验溶液中是否含有Fe2+ |
向溶液中滴入氯水后,再滴加KSCN溶液 |
| B |
除去CO2中的HCl气体 |
通过饱和的NaHCO3溶液,然后干燥 |
| C |
除去乙酸乙酯中的乙酸 |
加入足量的NaOH溶液,然后分液 |
| D |
证明H2CO3酸性比H2SiO3强 |
Na2CO3和SiO2在高温下熔融反应 |
下列物质间的转化无法实现的是