放热反应CO(g)+H2O(g)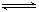 CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
| A.若增大CO的浓度,K2和K1都增大 | B.K2>K1 |
| C.c2(CO)=c2(H2O) | D.c1(CO)>c2(CO) |
低合金高强度钢Q460是支撑“鸟巢”的铁骨钢筋,除含有铁元素外,还含有Mn(锰)、Ti(钛)、Cr(铬)、Nb(铌)等合金元素,下列有关说法正确的是
| A.Fe位于元素周期表的第四周期、第ⅧB族 |
| B.Q460比纯铁的硬度大 |
C.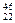 TiO2、 TiO2、 TiO2、 TiO2、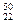 TiO2互为同位素 TiO2互为同位素 |
D.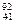 Nb3+原子核内有51个中子,核外有41个电子 Nb3+原子核内有51个中子,核外有41个电子 |
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关 X性质的描述中错误的是
| A.X单质不易与水反应 | B.XO2可被碳或氢气还原为X |
| C.XCl4的沸点比SiCl4的高 | D.XH4的稳定性比SiH4的高 |
下列叙述中,正确的是
| A.化学反应中物质变化的实质是旧化学键的断裂和新化学键的形成 |
| B.离子化合物中一定有金属元素 |
| C.蛋白质溶液、淀粉溶液和葡萄糖溶液都是胶体 |
| D.共价化合物中各原子都一定满足最外层8电子稳定结构 |
下列物质的电子式书写正确的是
A.NaCl: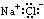 |
B.H2S: |
C.硫离子结构示意图: |
D.NH4I: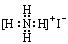 |
下列变化过程中,只破坏共价键的是
| A.I2升华 | B.NaF加热熔融 |
| C.HCl溶于水得盐酸 | D.蔗糖溶解 |