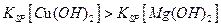下列推断正确的是( )
| A.SiO2能与NaOH溶液、HF溶液反应,所以SiO2是两性氧化物 |
| B.Na2O、Na2O2组成元素相同,阳离子与阴离子个数比也相同 |
| C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
已知CO和H2在一定条件下合成甲醇的反应为:
CO(g)+2H2(g) CH30H(g)
CH30H(g)
现在容积均为l L的a、b、c三个密闭容器中分别充入l molCO和2mol H2的混合气
体,控制温度,进行反应,测得相关数据的关系如图l和图2所示。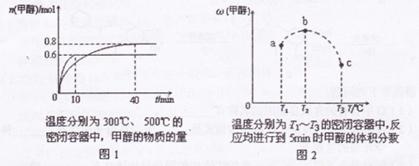
下列说法正确的是
A.该反应的正反应的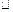 H<0 H<0 |
| B.反应进行到5min时,a容器中v(正)= v(逆) |
| C.升温或减压,可将b中的平衡状态转变成e中的平衡状态 |
| D.达到平衡时,a、b、c中CO转化率为b>a>c |
镁—过氧化氢燃料电池具有比能量高、安全方便等优点,
其结构示意图如图所示。
关于该电池的叙述正确的是
| A.该电池可以在高温下正常工作 |
| B.电池工作时,H+向正极移动 |
| C.电池工作时,正极周围溶液的pH将不断变小 |
| D.该电池的总反应式为: |
Mg+H202+H2S04=MgS04+2H20
绿原酸是咖啡提取液的成分之一,其结构如图所示。下列关于绿原酸的说法正确的是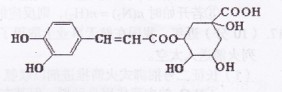
| A.分子式为C16H1809 |
| B.分子中有4个手性碳原子 |
| C.水解产物都可以与FeCl3溶液发生 显色反应 |
| D.在一定条件下,l mol该物质最多 |
可与8molNaOH反应
下列离子方程式与所述事实相符且正确的是
A.用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液: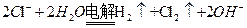 |
B.用稀硝酸清洗做过银镜反应的试管: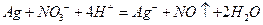 |
C.向FeBr2溶液中通入过量的 : :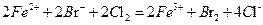 |
| D.在强碱性溶液中,次氯酸钠将Mn2+氧化成Mn02: |
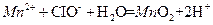
下列化学实验事实及解释都正确的是
| A.向Na2S03溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀出现,说明Na2S03溶 液已经变质 |
| B.向皂化反应后的混合物中加入食盐可分离出高级脂肪酸钠,说明高级脂肪酸钠在 此时容易析出 |
C.等体积、 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性: 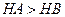 |
D.向浓度均为0.1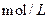 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成 |
Cu(OH)2沉淀,说明